Informe de Posicionamiento Terapéutico de ramucirumab (Cyramza®) en el cáncer de pulmón no microcítico
INFORME DE POSICIONAMIENTO TERAPÉUTICO
Informe de Posicionamiento Terapéutico de ramucirumab (Cyramza®) en el cáncer de pulmón no microcítico
IPT, 49/2016
Versión 1
Fecha de publicación: 21 de noviembre de 2016 †
El carcinoma de pulmón constituye la primera causa de muerte por cáncer en el mundo. La edad media de aparición del cáncer de pulmón se sitúa entre los 55 y los 75 años, siendo más frecuente en hombres que en mujeres (1).
En España en 2012, se diagnosticaron 26.715 casos de cáncer de pulmón, lo que representa el 16,9% de los tumores entre los hombres y el 5,7% entre las mujeres (2). La tasa de incidencia ajustada para la población masculina en nuestro país es de 52,5 por cada 100.000 habitantes/ año, y es superior a la tasa ajustada mundial (3,4). En el caso de las mujeres la tasa de incidencia ajustada (11,3 por cada 100.000 habitantes/ año) se sitúa algo por debajo de la tasa ajustada mundial (1, 3, 5).
Las cifras absolutas de mortalidad por cáncer de pulmón en España se han visto incrementadas año tras año desde la década de los 50 (3), aunque las tasas ajustadas en varones han disminuido. En el año 2012 se registraron 21.118 muertes a causa de cáncer de pulmón. La tasa de mortalidad ajustada en varones asciende a 40,3 por cada 100.000 habitantes/ año, siendo menor en el caso de las mujeres 8 por cada 100.000 habitantes/ año (2).
Los tumores pulmonares se clasifican en función de su histología en dos grandes grupos, carcinomas de pulmón microcíticos o de células pequeñas (representan aproximadamente un 15%-20% de los cánceres de pulmón) y carcinomas de pulmón no microcíticos o de células no pequeñas (CPNM; representan el 80%-85% restante de los cánceres de pulmón). EL CPNM incluye, fundamentalmente, los siguientes tipos histológicos: epidermoide, adenocarcinoma y de células grandes.
La caracterización del tumor es crucial por sus implicaciones tanto en el pronóstico como en el tratamiento de la enfermedad. Cuando la enfermedad se diagnostica en estadios tempranos es frecuentemente curable mediante cirugía (tasa de supervivencia a los 5 años del 70%); por el contrario, los pacientes diagnosticados de CPNM que debutan con enfermedad en estadío avanzado tienen peor pronóstico, reflejado en sus menores tasas de supervivencia (tasa de supervivencia a los 5 años del 9-13%) o peor aún en estadío metastásico con supervivencias medianas de 9-10 meses.
Las terapias de elección de pacientes con CPNM localmente avanzado (IIIB) o metastásico (IV) se han centrado tradicionalmente en la combinación de agentes quimioterápicos basados en platino. La co-administración de un platino con agentes tales como: taxanos, gemcitabina, vilnorelbina, pemetrexed, etopósido y vinblastina, ha demostrado aportar una ganancia en supervivencia global (SG), calidad de vida y control de síntomas en pacientes con buen estado funcional (PS 0-1).
Globalmente, estos regímenes han demostrado tener una eficacia similar, por lo que las diferencias en el perfil de seguridad son las que probablemente dirigen la elección de una terapia frente a otras, salvo en los subgrupos de pacientes con adenocarcinoma donde la combinación de platinos con pemetrexed o bevacizumab asociado a un doblete de platino confieren cierta ventaja en la supervivencia global (4, 5).
A pesar de las mejoras en los resultados obtenidos con los tratamientos de primera línea, los pacientes con CPNM avanzado o metastásico progresan siendo candidatos a recibir tratamiento de segunda línea. Actualmente, los fármacos aprobados en el tratamiento de segunda línea en pacientes en ausencia de mutaciones específicas son docetaxel, erlotinib, afatinib, pemetrexed y nivolumab en monoterapia, y de nintedanib en combinación con docetaxel.
RAMUCIRUMAB (CYRAMZA®)
Cyramza ® en combinación con docetaxel está indicado para el tratamiento de pacientes adultos con cáncer de pulmón no microcítico localmente avanzado o metastásico con progresión de la enfermedad tras quimioterapia basada en platino. También está indicado para el tratamiento de cáncer gástrico y cáncer colorrectal (6).
Ramucirumab 10 mg/ ml se encuentra disponible como concentrado para solución para perfusión.
La dosis recomendada de ramucirumab es 10 mg/ kg el día 1 de un ciclo de 21 días, en perfusión intravenosa de 60 minutos, antes de la perfusión de docetaxel. La dosis recomendada de docetaxel es 75 mg/ m 2 administrada por perfusión intravenosa durante aproximadamente 60 minutos el día 1 de un ciclo de 21 días.
Puede ser necesaria la interrupción del tratamiento o la reducción de dosis de acuerdo con la seguridad y tolerabilidad individual.
Farmacología
Ramucirumab es un anticuerpo monoclonal humanizado IgG1 dirigido contra el receptor 2 del factor de crecimiento del endotelio vascular (VEGFR-2) que es el mediador clave de la angiogénesis inducida por VEGF. Hasta ahora no se han identificado biomarcadores predictivos de la actividad de ramucirumab.
Eficacia
Los principales datos de eficacia de ramucirumab en CPNM localmente avanzado o metastásico proceden del ensayo clínico fase III REVEL.
El estudio REVEL fue un ensayo clínico fase III multicéntrico, doble ciego, aleatorizado, controlado con placebo que incluyó pacientes con CPNM en estadio IV escamoso o no escamoso que experimentaron progresión durante o tras a quimioterapia basada en platinos (excluyendo docetaxel) (7,8). También se incluyeron pacientes que habían recibido bevacizumab o tratamiento de mantenimiento. Se incluyeron pacientes ≥ 18 años con puntuación ECOG 0-1.
Se excluyeron pacientes con metástasis cerebrales sintomáticas o no tratadas y pacientes con cirrosis. Se excluyeron pacientes con hemorragia grave y reciente, compromiso tumoral de las vías respiratorias principales o vasos sanguíneos, cavitación intratumoral o con alteraciones trombóticas; así como pacientes en tratamiento con anticoagulantes, antiinflamatorios no esteroideos o antiagregantes plaquetarios.
Los pacientes fueron aleatorizados (1:1) para recibir ramucirumab (10 mg/ Kg) –docetaxel (75 mg/ m 2 ) o placebo– docetaxel (75 mg/ m 2 ) cada 3 semanas. Los pacientes fueron tratados hasta progresión clínica o radiológica o toxicidad inaceptable. Las evaluaciones del tumor se realizaron de acuerdo con los “Criterios de Evaluación de Respuesta en Tumores Sólidos” (RECIST) versión 1.1 cada 6 semanas. Tras la discontinuación del tratamiento, se siguió a los pacientes durante 8 semanas para evaluar la supervivencia.
La aleatorización fue estratificada por puntuación ECOG (0 vs 1), sexo, terapia de mantenimiento previa (si vs no) y área geográfica (este de Asia vs resto de mundo).
La variable principal del estudio fue la supervivencia global (SG) definida como el tiempo desde la aleatorización hasta muerte por cualquier causa.
Las variables secundarias incluyeron supervivencia libre de progresión (SLP), definida como el tiempo desde la aleatorización hasta progresión de la enfermedad o muerte; tasa de respuesta objetiva (TRO), definida como el porcentaje de pacientes que alcanza respuesta completa (RC) o respuesta parcial (RP) y tasa de control de la enfermedad (TCE), definida como el porcentaje de pacientes que alcanzan RC, RP o enfermedad estable (EE).
Además, se evaluó la calidad de vida relacionada con la salud (CVRS) mediante los cuestionarios LCSS y EQ5D realizados a nivel basal, el día 21 de cada ciclo, al final del tratamiento y el día 30 durante el periodo de seguimiento. Por otro lado, se llevó a cabo un análisis exploratorio de biomarcadores.
El análisis principal de eficacia se llevó a cabo en la población por intención de tratar (ITT), definida como todos los pacientes aleatorizados, independientemente de si recibieron o no la medicación en estudio. El análisis principal de supervivencia se llevó a cabo mediante el método de Kaplan-Meyer y la SG de ambos tratamientos se comparó usando el test log-rank. Se utilizaron también modelos de regresión de Cox para comparar los tratamientos en términos de SG y SLP. Los resultados del resto de variables se expresaron como intervalos de confianza del 95%. El análisis se realizó en todos los subgrupos incluidos en la estratificación inicial.
Las variables principal y las secundarias se analizaron ajustando por factores potencialmente pronóstico como hábito tabáquico, histología, respuesta a platinos, tratamiento previo con taxanos, tratamiento previo con bevacizumab, expresión EGFR, edad, raza y tiempo desde la última terapia administrada, además de los factores incluidos en la estratificación.
La seguridad se evaluó en todos los pacientes que recibieron al menos una dosis de tratamiento.
Se reclutaron un total de 1253 pacientes (población ITT), de los cuales 628 fueron aleatorizados para recibir ramucirumab + docetaxel y 625 placebo + docetaxel.
Las características basales de los pacientes estuvieron, en general, equilibradas en ambos grupos de tratamiento. La mediana de edad fue 62 años con un 36,3% de los pacientes de 65 años o mayores. La proporción de mujeres fue de 33,4% y el 82,1% fueron individuos de raza blanca. El estado funcional fue 0 en el 32,4% y 1 en el 67,4% de los pacientes. El 77,8% no recibieron terapia de mantenimiento previa mientras que en un 62% de los pacientes había transcurrido menos de 9 meses desde el último tratamiento
El 58,0% de los pacientes presentó adenocarcinoma, el 12,2% otros tumores no escamosos y el 26,2% presentó tumores escamosos.
El estadio del tumor fue IV, IIIB y IIIA en un 79,2%, 7,0% y 6,5% de los casos, respectivamente. La mediana de duración de la enfermedad fue de 9 meses. La mediana del tamaño del tumor fue de 6,8 cm y el 85,6% de los pacientes presentó 2 o más lesiones metastásicas.
El 55,1% habían recibido tratamiento previo para la enfermedad metastásica, el 22,2% terapia de mantenimiento y el 32,7% tratamiento paliativo. El 24,3% habían recibido tratamiento previo con taxanos y el 14,4% con bevazizumab.
La mediana de duración del tratamiento con docetaxel fue de 14,1 y 12,0 semanas para los grupos de ramucirumab + docetaxel y placebo + docetaxel, respectivamente.
No hubo diferencias significativas en el uso de tratamientos post- progresión. Los tratamientos sistémicos más utilizados fueron EGFR TKIs, gemcitabina, vinorelbina, pemetrexed, platinos y taxanos. Los pacientes no recibieron ningún fármaco anti PD-L1 o anti PD-1.
En relación a la SG, en el momento del análisis de los datos habían ocurrido un 70,6% de eventos. La mediana de la SG fue de 10,5 meses (IC 95%: 9,5 – 11,2) para el grupo de ramucirumab + docetaxel y de 9,1 meses (IC 95%: 8,4 – 10,0) para el grupo que recibió placebo + docetaxel (HR: 0,857; IC 95%: 0,75 – 0,98). La tasa de supervivencia a los 12 meses fue del 42,9% (IC 95%: 38,9% – 46,9%) y del 37,7% (IC 95%: 33,8% - 41,5%) para los grupos de ramucirumab + docetaxel y placebo + docetaxel, respectivamente. La tasa de supervivencia a los 24 meses fue de 20,9% (IC 95%: 17,0% - 25,1%) y de 17,5% (IC 95%: 13,8% - 21,5%) para los grupos de ramucirumab + docetaxel y placebo + docetaxel, respectivamente (tabla 1 y figura 1).
Tabla 1: Resumen de los datos de eficacia. Población ITT
| Cyramza más docetaxel N=628 | Placebo más docetaxel N=625 | |
| Supervivencia Global, meses | ||
| Mediana – meses (IC 95%) | 10,5 (9,5; 11,2) | 9,1 (8,4; 10,0) |
| Hazard ratio (IC 95%) | 0,857 (0,751; 0,979) | |
| Valor de p estratificado (Log-rank) | 0,024 | |
| Supervivencia Libre de Progresión, meses | ||
| Mediana (IC 95%) | 4,5 (4,2; 5,4) | 3,0 (2,8; 3,9) |
| Hazard Ratio (IC 95%) | 0,762 (0,677; 0,859) | |
| Valor de p estratificado (Log-rank) | <0,001 | |
| Ratio de respuesta objetiva (CR + PR) | ||
| Ratio – porcentaje (IC 95%) | 22,9 (19,7; 26,4) | 13,6 (11,0; 16,5) |
| Valor de p estratificado (CMH) | <0,001 | |
Abreviaturas: IC= intervalo de confianza, CR= respuesta completa, PR= respuesta parcial, CMH = Cochran- Mantel-Haenszel
Figura 1: Curvas de Kaplan-Meyer para supervivencia global de ramucirumab + docetaxel frente a placebo más docetaxel
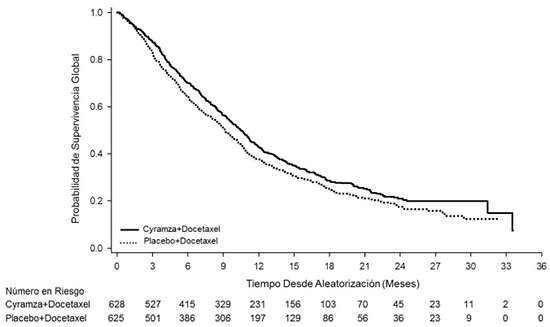
En relación a la SLP, en el momento del análisis de los datos habían ocurrido un 91,1% de eventos. La mediana de SLP fue de 4,5 meses (IC 95%: 4,2 – 5,3) en el grupo que recibió ramucirumab + docetaxel y de 3,0 meses (IC 95%: 2,8 – 3,9) en el grupo que recibió placebo + docetaxel (HR: 0,76; IC 95%: 0,68 – 0,86). La tasa de SLP a los 3 meses fue de 64,7% (IC 95%: 60,7% - 68,3%) y de 50,1% (IC 95%: 46,1% - 54,0%) para los grupos de ramucirumab + docetaxel y placebo + docetaxel, respectivamente. La tasa de SLP a los 6 meses fue de 35,9% (IC 95%: 32,0% - 39,8%) y de 29,1% (IC 95%: 25,5% - 32,7%) para los grupos de ramucirumab + docetaxel y placebo + docetaxel, respectivamente (tabla 1 y figura 2).
Figura 2: Curvas de Kaplan-Meyer para supervivencia libre de progresión de ramucirumab + docetaxel frente a placebo más docetaxel
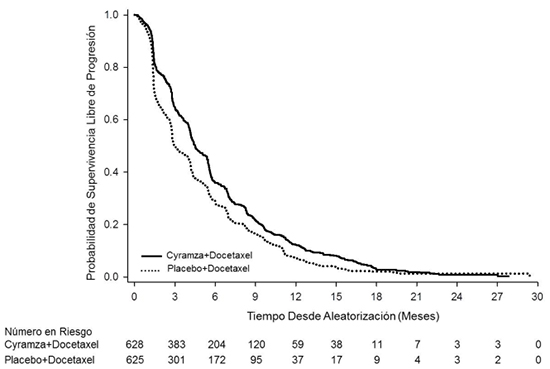
La TRO fue significativamente mejor en el grupo de ramucirumab (22,9%, IC 95%: 19,7% – 26,4%) comparado con el grupo de placebo (13,6%, IC 95%: 11,0% – 16,5%). La TCE también fue significativamente mejor en el grupo de ramucirumab (64%; IC 95%: 60,1% - 67,8%) comparado con el grupo de placebo (52,6%, IC 95%: 48,6% - 56,6%) (tabla 1).
El análisis de la CVRS mostró un tiempo hasta deterioro similar entre los grupos de tratamiento según las puntuaciones de LCSS.
Los principales subgrupos en los que se observó un efecto favorable estadísticamente significativo para ramucirumab en términos de SG fueron pacientes con histología no escamosa, pacientes menores de 65 años, pacientes con mantenimiento previo, aquellos en los que el comienzo de la terapia previa fue < 9 meses y aquellos en los que el tratamiento previo fue distinto de bevacizumab (figura 3).
En relación al tipo histológico, los estudios de subgrupos en el estudio REVEL mostraron una mediana de SG de los pacientes con histología no escamosa tratados con ramucirumab en combinación con docetaxel de 11,1 meses frente a 9,7 meses en los pacientes tratados sólo con docetaxel (HR: 0,83; p=0,02) (tabla 2). En los pacientes con histología escamosa, la SG no fue significativamente distinta entre los grupos de tratamiento. Además, la SLP fue favorable para el grupo de ramucirumab en combinación con docetaxel en todos los tipos histológicos. Por otro lado, la tasa de respuesta global (RC + RP) fue mejor en el grupo de ramucirumab tanto en histología escamosa como en no escamosa.
En relación a la presencia de mutación EGFR, el estudio REVEL no mostró diferencias significativas de SG en ninguno de los subgrupos analizados (mutación, no mutación, desconocida). Sin embargo, la SLP fue mayor en los pacientes que recibieron ramucirumab en combinación con docetaxel frente a los que recibieron sólo docetaxel en los pacientes que no presentaron mutación EGFR y en los que esta era desconocida.
Figura 3: Forest plot SG por subgrupos de pacientes
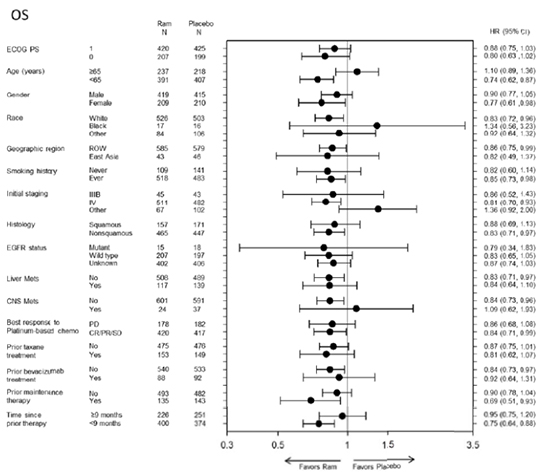
Tabla 2: SG y SLP por tipo histológico
| Median OS (months) | Median PFS (months) | |||||||
| Histology | Ram N | Plac N | Ramucdocet | Placebodocet | HR (p-value) | Ramuc- docet | Placebo -docet | HR (p-value) |
| Nonsquamous (n=912) | 465 | 447 | 11.1 (9.9-12.3) | 9.7 (8.5-10.6) | 0.83 (0.02) | 4.6 (4.3-5.5) | 3.7 (2.8-4.1) | 0.77 (<0.001) |
| Adenocarninoma (n=725) | 377 | 348 | 11.2 (9.9-12.4) | 9.8 (8.6-10.8) | 0.83 (0.039) | 4.5 (4.2-5.5) | 3.9 (2.8-4.2) | 0.78 (0.001) |
| Large cell (n=35) | 14 | 21 | 8.6 (4.2-NA) | 10.7 (5.7-13.2) | 0.73 (0.42) | 2.7 (1.4-6.0) | 3.0 (1.3-5.3) | 0.70 (0.350) |
| Other (n=152) | 74 | 78 | 10.8 (8.3-12.3) | 9.3 (5.0-11.3) | 0.86 (0.44) | 5.4 (4.1-6.2) | 2.9 (1.7-4.3) | 0.72 (0.048) |
| Squamous cell (n=328) | 157 | 171 | 9.5 (8.0-10.8) | 8.2 (6.3-9.4) | 0.88 (0.32) | 4.2 (3.6-5.4) | 2.7 (2.5-2.9) | 0.76 (0.019) |
En relación al tratamiento previo, no hubo diferencias significativas en la SG de ramucirumab en combinación con docetaxel frente a docetaxel en los pacientes que habían recibido tratamiento previo con taxanos ni en los que no lo habían recibido. Sin embargo, la SLP sí fue significativamente favorable para ramucirumab en combinación con docetaxel en los pacientes que no había recibido tratamiento previo con taxanos (HR: 0,74; IC 95%: 0,64-0,84). Por otro lado, tanto la SG como la SLP fueron significativamente mayores en el grupo de ramucirumab + docetaxel en los pacientes que no habían recibido tratamiento previo con bevazicumab (HR: 0,77; IC 95%: 0,68-0,87). En los pacientes que habían recibido bevazicumab no se observaron diferencias significativas, aunque esto podría ser debido al pequeño tamaño muestral de este subgrupo de pacientes. La SG fue significativamente más favorable para ramucirumab en combinación con docetaxel en los pacientes que habían recibido terapia de mantenimiento (HR: 0,69; IC 95%: 0,51-0,93) y la SLP también fue significativamente favorable tanto en los que recibieron terapia de mantenimiento (HR: 0,74; IC 95%: 0,58-0,95) como en los que no la recibieron (HR: 0,79; IC 95%: 0,69-0,90).
Se llevó a cabo un análisis de sensibilidad, en el que se consideró que todos los pacientes que discontinuaron el tratamiento por decisión propia habían progresado y los resultados fueron similares a los obtenidos en el análisis principal.
Seguridad
Teniendo en cuenta la evidencia en las distintas indicaciones de ramucirumab, las reacciones adversas más frecuentes observadas en los pacientes (como agente único o en combinación con quimioterapia citotóxica) son: neutropenia, fatiga/ astenia, leucopenia, epistaxis, diarrea y estomatitis. Las reacciones adversas más graves son: perforación gastrointestinal, hemorragia gastrointestinal grave y enfermedad tromboembólica arterial (6).
En total, 1.404 pacientes recibieron ramucirumab en combinación con docetaxel para el tratamiento de CPNM, de los cuales 627 pertenecen al estudio REVEL. En el estudio REVEL la mediana de la exposición al tratamiento con docetaxel fue de 14,1 y 12,0 semanas para los grupos de ramucirumab + docetaxel y placebo + docetaxel, respectivamente (7,8).
Las reacciones adversas a ramucirumab comunicadas en el estudio REVEL se registraron de acuerdo con el Sistema de Clasificación de Organos (MedDRA). Las reacciones adversas en el estudio REVEL que ocurrieron en ≥ 5% de pacientes que recibieron ramucirumab + docetaxel vs placebo + docetaxel, respectivamente, fueron neutropenia febril (15,9% vs 10,0%), neutropenia (55,0% vs 46,0%), trombocitopenia (13,4% vs 5,2%), hipertensión (10,8% vs 4,9%), epistaxis (18,5% vs 6,5%), estomatitis (23,3% vs 12,9%), fatiga/astenia (54,7% vs 50,0%), inflamación de la mucosa (16,1% vs 7,0%) y edema periférico (16,3% vs 8,6%). Otras reacciones adversas que ocurrieron entre un ≥ 1% y < 5% en los pacientes tratados con ramucirumab fueron hiponatremia, proteinuria y perforación gastrointestinal. Todas ellas fueron más frecuentes en el grupo de ramucirumab que en el de placebo. En general, los pacientes tratados con la combinación de ramucirumab tuvieron un porcentaje similar de efectos adversos con respecto a los tratados con docetaxel y placebo (97,8% vs 96,1 respectivamente).
Las reacciones adversas Grado ≥ 3 notificados en el estudio REVEL en el grupo de pacientes tratados con ramucirumab fueron neutropenia (48,8%), neutropenia febril (15,9%), trombocitopenia (2,9%), fatiga/astenia (14,0%), hipertensión (5,6%), estomatitis (4,3%), inflamación de la mucosa (2,9%) y epistaxis (0,3%). La frecuencia de efectos adversos grado 3 o superior fue similar en ambos grupos de tratamiento (79% vs 72% respectivamente).
Los pacientes en tratamiento con ramucirumab + docetaxel tuvieron que retrasar el tratamiento de forma más frecuente que aquellos en tratamiento con placebo + docetaxel (41,0% vs 29,9%). Los pacientes en tratamiento con ramicirumab también tuvieron que reducir la dosis más frecuentemente que el grupo comparador (7,5% vs 3,9%). La discontinuación del tratamiento debida a reacciones adversas fue más frecuente en los pacientes que recibieron ramucirumab que en los pacientes que recibieron placebo (9,3% vs 5,2%). Las reacciones adversas que dieron lugar a discontinuación de ramucirumab de forma más frecuente fueron reacciones asociadas a la infusión y epistaxis. Las reacciones adversas que dieron lugar a discontinuación de docetaxel en el grupo de ramucirumab + docetaxel de forma más frecuente fueron fatiga, neuropatía periférica motora y neuropatía periférica sensorial.
No hubo diferencias significativas en el porcentaje de pacientes con efectos adversos que condujeron a la muerte entre el grupo de estudio con ramucirumab y el grupo placebo (5,4% vs 5,7%).
La frecuencia de reacciones adversas fue mayor, en general, en los pacientes ≥ 65 años que en los más jóvenes. Los pacientes mayores presentaron mayor frecuencia de fatiga, anemia, trombocitopenia, neutropenia febril, diarrea, nausea, disnea, edema periférico y deshidratación.
DISCUSIÓN
El ensayo clínico REVEL ofrece la comparación directa de ramucirumab en combinación con docetaxel frente a docetaxel, que es una de las terapias de elección en segunda línea en esta población de pacientes (7, 8). Por tanto, los resultados del ensayo clínico REVEL suponen una contribución relevante para el posicionamiento de ramucirumab en el arsenal terapéutico. Por otro lado, la variable principal de eficacia SG utilizada en el estudio se considera relevante dada la corta expectativa de vida de estos pacientes.
En el estudio REVEL, los resultados de SG mostraron una mejora estadísticamente significativa en el grupo de ramucirumab + docetaxel comparado con el grupo de placebo + docetaxel (HR: 0,86; IC 95%: 0,75 – 0,98), con una mediana de incremento en la supervivencia de 1,4 meses.
La SLP, evaluada por el investigador, también fue estadísticamente superior en el grupo de ramucirumab comparado con el grupo de placebo (HR: 0,76; IC 95%: 0,68 – 0,86) con una mediana de incremento de 1,5 meses. La tasa objetiva de respuesta también fue favorable para ramucirumab (22,9% vs 13,6%, p<0,001).
En general, la evaluación de la CVRS sugirió que no hay deterioro en la calidad de vida de los pacientes tratados con ramucirumab.
En relación a los análisis de subgrupos, dado su carácter exploratorio, es importante interpretar los resultados de los mismos con cautela. Los resultados de SG y SLP fueron en general consistentes en la mayoría de los subgrupos analizados. Sin embargo, aquellos que parecen presentar una respuesta más favorable al tratamiento con ramucirumab son pacientes con histología no escamosa, pacientes menores de 65 años frente a ≥ 65 años, pacientes con terapia de mantenimiento previa, aquellos en los que el comienzo de la terapia previa fue < 9 meses y aquellos en los que el tratamiento previo fue distinto de taxanos y distinto de bevacizumab.
En relación a los pacientes con histología escamosa, si bien el análisis no muestra diferencias en términos de SG, sí que lo hace en SLP y en tasa de respuesta. Esta ausencia de significación estadística en SG podría deberse al tamaño muestral, dada la similitud de la ganancia según los estimadores (medianas) y del HR entre este subgrupo y los pacientes con adenocarcinoma.
Si bien el análisis pormenorizado y ajustado por factores pronóstico en diferentes rangos de edad mostró un HR de SG con tendencia positiva en todos los subgrupos, este fue claramente peor en los grupos de mayor edad (>65). Por tanto, parece que la eficacia puede disminuir en pacientes mayores, por lo que las comorbilidades asociadas a la edad, el estado funcional y la tolerabilidad de la quimioterapia deberían ser evaluadas antes de comenzar el tratamiento en población mayor.
El subgrupo de pacientes evaluado para el estado de la mutación EGFR fue demasiado pequeño para extraer conclusiones al respecto. Sin embargo, la SLP fue favorable para ramucirumab combinado con docetaxel en los pacientes que no presentaron mutación EGFR o esta era desconocida.
En relación a la seguridad las reacciones adversas conocidas para docetaxel se vieron incrementadas, en general, con la administración de ramucirumab. Los pacientes tratados con la combinación experimentaron más neutropenia, febril neutropenia, trombocitopenia y estomatitis, tanto de manera general como en toxicidades grado 3-4.
Por otra parte, ramucirumab es un tratamiento antiangiogénico y puede aumentar el riesgo de hemorragia. En los ensayos clínicos se excluyeron aquellos pacientes con CPNM con hemorragia pulmonar reciente, pacientes con cavitación tumoral o con afectación de grandes vasos sanguíneos, así como aquellos con tratamiento anticoagulante, agentes antiplaquetarios o antiinflamatorios no esteroideos.
Ramucirumab está contraindicado donde haya cavitación del tumor o afectación tumoral de los grandes vasos sanguíneos.
A este respecto, es importante tener en cuenta que los pacientes con histología escamosa tienen mayor riesgo de desarrollar hemorragia pulmonar grave.
No existe suficiente evidencia de que los pacientes de 65 años o mayores tengan mayor riesgo de sufrir reacciones adversas comparando con los pacientes menores de 65 años. No se recomienda la reducción de dosis.
Los pacientes con estado funcional ECOG ≥ 2 fueron excluidos del estudio pivotal por lo que se desconoce la seguridad y eficacia de ramucirumab en esta población de pacientes.
En relación a otras terapias utilizadas y actualmente disponibles en CPNM localmente avanzado o metastásico tras fallo a tratamiento con quimioterapia basada en platino y por tanto potenciales comparadores, cabe destacar, nivolumab, pembrolizumab, erlotinib, afatinib, pemetrexed en monoterapia, y nintedanib combinado con docetaxel.
Nivolumab está indicado en CPNM de histología escamosa y no escamosa, localmente avanzado o metastásico después de quimioterapia previa, en pacientes adultos. Nivolumab demostró mejora en la supervivencia comparado con docetaxel tras progresión después de una primera línea basada en un doblete de platino (9).
En histología escamosa, el estudio CA209017 fue un ensayo fase 3, aleatorizado y abierto, donde nivolumab se comparó frente a docetaxel en pacientes que habían experimentado una progresión de la enfermedad durante o después de un régimen de quimioterapia basado en un doblete de platino y un estado funcional ECOG de 0 a 1. La variable principal fue la SG y las variables secundarias evaluadas por el investigador fueron la TRO y la SLP. La mediana de edad fue 63 años con 44% ≥65 años de edad y 11% ≥75 años de edad. El treinta y uno por ciento tenían enfermedad progresiva notificada como respuesta mejor a su régimen de tratamiento previo más reciente y un 45% recibió nivolumab dentro de los 3 meses después de completar su régimen de tratamiento previo más reciente. El nivel basal del estado funcional ECOG fue 0 (24%) o 1 (76%). El uso de nivolumab proporcionó una mediana de SG de 9,23 meses frente a 6,01 meses para docetaxel (HR 0.59 IC95% 0,43; 0,81). La tasa de respuesta fue del 20% vs 8,8% (nivolumab y docetaxel respectivamente). Se observó beneficio en la supervivencia independientemente de que los pacientes se hubiesen clasificado como PD-L1 positivo o PD-L1 negativo, (la expresión de PD-L1 en la membrana del tumor, estará por encima del límite de 1%, 5% o 10%). Sin embargo, el papel de este biomarcador (expresión de PD- L1 en el tumor) no se ha aclarado completamente (10, 11).
Por otro lado, la evidencia de nivolumab en el tratamiento de CPNM no escamoso se basa fundamentalmente en el estudio CA209057 (ensayo fase 3, aleatorizado y abierto frente a docetaxel) (12). El ensayo incluyó pacientes que habían experimentado una progresión de la enfermedad durante o después de un tratamiento de quimioterapia basado en un doblete de platino, que podría estar incluido en el tratamiento de mantenimiento y que tuvieran un estado funcional ECOG de 0 ó 1. Se permitió una línea adicional de tratamiento con TKIs para los pacientes con mutación conocida de EGFR o translocación de ALK. La variable principal fue la SG. Las variables secundarias evaluadas por el investigador fueron la TRO y la SLP. La mediana de edad fue 62 años con un 34% ≥65 años y un 7% ≥75 años. El nivel basal del estado funcional ECOG fue 0 (31%) o 1 (69%). Setenta y nueve por ciento de los pacientes eran exfumadores/fumadores. El tratamiento con nivolumab resultó en una mediana de SG de 12,19 meses frente al tratamiento con docetaxel con una mediana de 9,36 meses (HR: 0,73; IC95% 0,59; 0,89). La tasa de respuesta fue del 19.2% y del 12,4% respectivamente para nivolumab y docetaxel. Los pacientes con mayor nivel de expresión PD-L1 (≥10%), experimentaron tanto una TRO (37,2%) como una SG [19,4 meses (IC95% 15,2, NA)] mayores, en comparación con docetaxel [12,7%, 7,95 meses (IC95% 6,3-10], respectivamente], si bien el punto de corte óptimo no se ha determinado aún. En pacientes con expresión de PDL-1 reducida (<1%) o nula, no se confirma beneficio en supervivencia respecto a docetaxel, si bien nivolumab presenta un mejor perfil de seguridad. En este subgrupo, los datos podrían ser incluso desfavorables en pacientes que presentan un peor pronóstico.
Pembrolizumab recibió en junio de 2016 opinión positiva por el CHMP para el tratamiento del CPNM localmente avanzado o metastásico en adultos cuyo tumor expresa PD-L1 y que han recibido al menos un tratamiento previo con quimioterapia. En pacientes con mutaciones positivas de EGFR y ALK los pacientes deben haber recibido las terapias aprobadas para estas mutaciones antes de recibir pembrolizumab.
Pembrolizumab ha sido estudiado a la dosis de 2 mg/ kg en un ensayo controlado frente a docetaxel en pacientes con CPNM [escamoso (21%) y no escamoso (70%)] tratados previamente con quimioterapia y con una mediana de edad de 63 años y con un estado funcional ECOG de 0 y 1. Mostró un mediana de SG de 10,4 meses (HR 0,71 IC95% 0,58-0,88) y 14,9 meses (HR 0,61 IC95% 0,49- 0,75) frente a 8,5- 8,2 meses para docetaxel (en función de la expresión de PD-L1; >1% y >50% respectivamente), con una tasa de respuesta del 18% al 30% vs 8-9% para docetaxel (también en función de la expresión de PD-L1; >1% y >50% respectivamente). En aquellos pacientes con tumores que no expresen PD-L1, no se ha establecido la eficacia y seguridad de pembrolizumab. Además, en el análisis de subgrupos, se observó un beneficio reducido de la supervivencia con pembrolizumab comparado con docetaxel, en pacientes que nunca fueron fumadores o en pacientes con tumores que albergaban la activación de mutaciones de EGFR, que recibieron al menos quimioterapia basada en platino y un inhibidor de tirosina kinasa.
Erlotinib está indicado en el tratamiento de pacientes con CPNM localmente avanzado o metastásico tras fallo, al menos, a un tratamiento quimioterápico anterior. Además está indicado en el tratamiento de primera línea de pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico con mutaciones activadoras de EGFR y en el tratamiento de mantenimiento de pacientes con CPNM localmente avanzado o metastásico con mutaciones activadoras de EGFR y enfermedad estable después de un régimen quimioterápico de primera línea (13). Erlotinib a dosis de 150mg/ 24h mostró superioridad frente a placebo con una mediana de supervivencia de 6,7 meses vs 4,7 meses en pacientes que habían recibido previamente una o dos líneas de quimioterapia. Además, los estudios fase III, como TAILOR (14), TITAN (15) y DELTA (16), compararon erlotinib frente a quimioterapia como segunda línea tratamiento. En el estudio TAILOR se observó una diferencia de 2,8 meses en la mediana de SG que resultó ser estadísticamente significativa a favor de docetaxel (8,2 meses y 5,4 meses en el grupo de docetaxel y erlotinib respectivamente) (HR: 0,73; IC95%: 0,53-1,00), así como un incremento en la SLP en favor de docetaxel (2,9 vs 2,4 meses respectivamente) (HR: 0,71; IC95%: 0,53-0,95). La tasa de respuesta fue significativamente mayor con docetaxel (15,5%) que con erlotinib (3%).
En el estudio TITAN (15) no se encontraron diferencias entre los dos brazos del estudio con respecto a la SG (5,3 meses con erlotinib vs 5,5 meses con la quimioterapia (docetaxel o pemetrexed) (HR: 0,96; IC95%: 0,78-1,19), y se observó una tendencia en favor del brazo de quimioterapia en términos de SLP (6,3 vs 8,6 semanas (HR: 1,2; IC95%: 1,0-1,5). El estado de la mutación EGFR se analizó en 160 pacientes (140 pacientes sin mutación EGFR), la SG en esta subpoblación fue mayor para erlotinib, pero no estadísticamente significativa (6,6 vs 4,4 meses) (HR: 0,8; IC95%: 0,6-1,2).
El estudio DELTA (16), en población japonesa, no halló diferencias en la SLP (2 meses vs 3,2 meses) con erlotinib y docetaxel respectivamente [HR 1,22; IC95% (0,97; 1,55)], ni en SG (14,8 meses vs 12,2) en erlotinib y docetaxel respectivamente [HR 0,91; IC95% (0,68; 1,22)] o tasa de respuesta objetiva (17% vs 17,9% con erlotinib y docetaxel respectivamente). En el subgrupo de pacientes sin mutación EGFR se encontraron diferencias en la SLP (1,3 meses con erlotinib frente a 2,9 meses con docetaxel) [HR 1,45; IC95% (1,09; 1,94)] pero no en la SG (9 meses con erlotinib frente a 10,1 meses con docetaxel) [HR 0,98; IC95% (0,69; 1,39)].
Afatinib en monoterapia está indicado para el tratamiento de CPNM localmente avanzado o metastásico de histología escamosa que progrese durante o tras quimioterapia basada en platino. Además, está autorizado en pacientes adultos naïve (sin tratamiento previo) a inhibidores de la tirosin quinasa (TKI) del Receptor del Factor de Crecimiento Epidérmico (EGFR) con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico con mutaciones activadoras del EGFR (17).
Un estudio que comparó afatinib con erlotinib como tratamientos de segunda línea de CPNM, demostró un aumento en SG para afatinib con respecto a erlotinib (mediana de SG 7,9 vs 6,8 meses, respectivamente) [HR: 0,81; IC95%: (0,69–0,95)]. Los resultados de SLP, variable principal del estudio (mediana de SLP 2,6 meses vs 1,9 meses) [HR: 0,81; IC95%: (0,69–0,96)] y la actividad antitumoral (5,5% vs 2,8%) también mostraron un mayor beneficio para afatinib (18).
Pemetrexed en monoterapia está indicado para el tratamiento en segunda línea de pacientes con cáncer de pulmón no microcítico localmente avanzado o metastásico, salvo aquellos que tengan histología predominantemente de célula escamosa (19). Pemetrexed se comparó frente a docetaxel en pacientes con CPNM avanzado que habían progresado a una primera línea de quimioterapia. Los resultados del estudio no mostraron diferencias significativas en términos de tasas de respuesta (9,1% y 8,8%, respectivamente), ni en términos de SG con una mediana de tiempo hasta muerte de 8,3 y 7,9 meses para pemetrexed y docetaxel, respectivamente (HR 0,99; IC95%: 0,82-1,20). Sin embargo, debido a la heterogeneidad en la histología de los pacientes incluidos en el estudio, se realizó un análisis de la SG en base a la misma, encontrándose diferencias a favor de pemetrexed en la histología no escamosa (9,3 frente a 8 meses), (HR: 0,78; IC95%: 0,61-1,00) y a favor de docetaxel en el caso de histología escamoso (6,2 frente a 7,4 meses), (HR: 1,56; IC95%: 1,08-2,26), lo que como se indicó anteriormente, llevó a la autorización de pemetrexed en pacientes que no tuvieran histología predominantemente de células escamosas (20).
A la vista de los resultados anteriormente descritos, tanto permetrexed, como afatinib y en menor medida erlotinib, parecen obtener una eficacia comparable a docetaxel en monoterapia en una población similar a la incluida en el estudio REVEL, con, a priori, una mejor tolerabilidad frente a la combinación de ramucirumab y docetaxel.
Nintedanib está autorizado en combinación con docetaxel para el tratamiento de pacientes adultos con CPNM localmente avanzado, metastásico o localmente recidivante con histología de adenocarcinoma, después de una primera línea de quimioterapia (21). La principal evidencia para esta indicación es un estudio fase III, 1199.13 (LUME-Lung 1), que comparó nintedanib en combinación con docetaxel frente a placebo más docetaxel como tratamiento de segunda línea de pacientes con CPNM avanzado. El ensayo incluyó a 658 pacientes (50,1%) con adenocarcinoma, 555 pacientes (42,2%) con carcinoma epidermoide y 101 pacientes (7,7%) con otras histologías tumorales. La mediana de edad era de 60,0 años y el estado ECOG basal era 0 (28,6%) o 1 (71,3%) (22).
La variable principal en este estudio fue la SLP, mientras que la SG fue una variable secundaria. La mediana de SLP fue significativamente favorable para el grupo de pacientes tratados con nintedanib + docetaxel (3,5 meses) frente al grupo tratado sólo con docetaxel (2,7 meses) (HR: 0,85; IC 95%: 0,75-0,96). La SG en el grupo tratado con nintedanib + docetaxel fue de 10,1 meses, mientras que en el grupo tratado sólo con docetaxel fue de 9,1 meses. Sin embargo, esta diferencia no fue estadísticamente significativa. El estudio evaluó un subgrupo de pacientes con histología de adenocarcinoma. En este caso tanto la mediana de SG como de SLP fueron favorables para el grupo de pacientes tratados con nintedanib en combinación con docetaxel frente al grupo de pacientes tratados sólo con docetaxel. [(SG: 12,6 vs 10,3; HR: 0,83; IC 95%: 0,70-0,99) (SLP: 4,2 vs 2,8; HR: 0,84; IC 95%: 0,71-1,00)] (22).
CONCLUSIÓN
La combinación de ramucirumab y docetaxel frente a la monoterapia con docetaxel ofrece un aumento marginal de la mediana de la supervivencia global (1,4 meses). Este aumento de la supervivencia está acompañado de una mayor toxicidad en relación a la administración de docetaxel en monoterapia.
Teniendo en cuenta la evidencia descrita, y con las incertidumbres que se desprenden de la ausencia de comparaciones directas, el uso de ramucirumab combinado con docetaxel en el tratamiento en segunda línea en pacientes con CPNM localmente avanzado o metastásico, no ofrece ventajas sobre las alternativas ya disponibles cuando el uso de nivolumab o pembrolizumab no se considere adecuado.
La elección de un tratamiento u otro deberá hacerse a nivel individual, de acuerdo con el perfil de reacciones adversas, la tolerancia del paciente, el tratamiento previo, el perfil histológico y la presencia de biomarcadores y mutaciones específicas.
Hasta el momento no se han identificado biomarcadores que seleccionen el grupo de pacientes que mas puedan beneficiarse del tratamiento con ramucirumab.
CONSIDERACIONES FINALES DEL GCPT
La Dirección general de Cartera Básica de Servicios del SNS y Farmacia ha emitido la resolución de no financiación para ramucirumab (Cyramza®) en combinación con docetaxel, para el tratamiento de pacientes adultos con cáncer de pulmón no microcítico localmente avanzado o metastásico con progresión de la enfermedad tras quimioterapia basada en platino.
REFERENCIAS:
1. Peters S, Adjei AA, Gridelli C et al. Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 23 (Supplement 7): vii56–vii64, 2012.
2. Globocan 2012. International Agency for Research on Cancer.
World Health Organization. http://globocan.iarc.fr.
3. Sánchez De Cos Escuín J. El cáncer de pulmón en España.
Epidemiología, supervivencia y tratamiento actuales. Arch Bronconeumol. Julio de 2009;45(7):341-8.
4. Schiller JH, Harrington D, Belani CP et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. N Engl J Med 2002; 346: 92–98.
5. Scagliotti, F. Phase III Randomized Trial Comparing Three Platinum-Based Doublets in Advanced Non–Small-Cell Lung Cancer. J Clin Oncol 2002; 20:4285-4291.
6. Ficha técnica de Cyramza (ramucirumab). Disponible en:
http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002829/WC500180724.pdf
7. Assessment report for Cyramza (ramucirumab). Disponible en:
http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Assessment_Report_-_Variation/human/002829/WC500203169.pdf
8. Garon EB, Ciuleanu TE, Arrieta O, et al. Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cáncer after disease progression on platinum-based therapy (REVEL): a multicentre, double-blind, randomized phase 3 trial. Lancet 2014; 384:665-73.
9. Ficha Técnica Opdivo (nivolumab). Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/003985/WC500189765.pdf.
10. European Public Assessment Report de nivolumab BMS.
Disponible en: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/003840/WC500190651.pdf. Acceso: Septiembre 2015.
11. Brahmer J et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non–Small-Cell Lung Cancer. N Engl J Med 2015; 373:123-35.
12. Borghaei, H et al. Nivolumab versus Docetaxel in Advanced Non squamous Non-Small-Cell Lung Cancer. N Engl J Med. 2015;373(17):1627-39.
13. Ficha técnica Tarceva (erlotinib). Disponible en:
http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000618/WC500033994.pdf.
14. Garassino MC, Martelli O, Broggini M, Farina G, Veronese S, Rulli E, et al. Erlotinib versus docetaxel as second-line treatment of patients with advanced non-small-cell lung cancer and wild- type EGFR tumours (TAILOR): a randomized controlled trial. Lancet Oncol 2013; 14:981–988.
15. Ciuleanu T, Stelmakh L, Cicenas S, Miliauskas S, Grigorescu AC, Hillenbach C, et al. Efficacy and safety of erlotinib versus chemotherapy in second-line treatment of patients with advanced, non-small-cell lung cancer with poor prognosis (TITAN): a randomised multicentre, open-label, phase 3 study. Lancet Oncol 2012; 13:300–308.
16. Randomized phase III trial of erlotinib versus docetaxel as second- or third-line therapy in patients with advanced non- small-cell lung cancer: Docetaxel and Erlotinib Lung Cancer Trial (DELTA). Kawaguchi T, et al. JCO JCO.2013.52.4694; published online on May 19, 2014
17. Ficha técnica Giotrif (afatinib). Disponible en:
http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002280/WC500152392.pdf.
18. Soria JC et al. Afatinib versus erlotinib as second-line treatment of patients with advanced squamous cell carcinoma of the lung (LUX-Lung 8): an open-label randomised controlled phase 3 trial Lancet Oncol. 2015 Aug;16(8):897-907.
19. Ficha técnica Alimta (pemetrexed). Disponible en:
http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000564/WC500025611.pdf.
20. Hanna N, Sheperd FA, Fosella F, Pereira JR, De Marinis F, von Pawel J, et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22:1589–1597.
21. Ficha técnica Vargatef (nintedanib). Disponible en:
http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002569/WC500179970.pdf.
22. Martin Reck MD, et al. Docetaxel plus nintedanib versus docetaxel plus placebo in patients with previously treated non- small-cell lung cancer (LUME-Lung 1): a phase 3, double-blind, randomized controlled trial. The Lancet Oncology, Volumen 15, Issue 2:143-155. February 2014.
GRUPO DE EXPERTOS
(por orden alfabético)
Agencia Española de Medicamentos y Productos Sanitarios
Comunidad Autónoma del Principado de Asturias
Todos los expertos han realizado una declaración de conflictos de interés.
El Laboratorio Titular, la Sociedad Española de Oncología Médica, la Sociedad Española de Farmacología Clínica, la Sociedad Española de Farmacia Hospitalaria y el Grupo Español de Pacientes con Cáncer han tenido oportunidad de enviar comentarios al documento, si bien el texto final es el adoptado por el GCPT.

