OPZELURA 15 MG/G CREMA
| ATC: Ruxolitinib |
| PA: Ruxolitinib |
Envases
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
3. - FORMA FARMACÉUTICA
4. - DATOS CLÍNICOS
5. - PROPIEDADES FARMACOLÓGICAS
6. - DATOS FARMACÉUTICOS
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
10. - FECHA DE LA REVISIÓN DEL TEXTO
 1. - NOMBRE DEL MEDICAMENTO
1. - NOMBRE DEL MEDICAMENTO
OPZELURA 15 mg/g Crema
 2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada gramo de crema contiene 15 mg de ruxolitinib (como fosfato).
? EXCIPIENTES CON EFECTO CONOCIDO
- Propilenglicol (E1520), 150 mg/g de crema
- Alcohol cetílico, 30 mg/g de crema
- Alcohol estearílico, 17,5 mg/g de crema
- Parahidroxibenzoato de metilo (E218), 1 mg/g de crema
- Parahidroxibenzoato de propilo, 0,5 mg/g de crema
- Butilhidroxitolueno (como antioxidante en parafina blanca) (E321)
Para consultar la lista completa de excipientes, ver sección 6.1.
 3. - FORMA FARMACÉUTICA
3. - FORMA FARMACÉUTICA
- Crema
- Crema de color blanco a blanquecino
 4. - DATOS CLÍNICOS
4. - DATOS CLÍNICOS
 4.1 - Indicaciones Terapéuticas de OPZELURA 15 mg/g Crema
4.1 - Indicaciones Terapéuticas de OPZELURA 15 mg/g Crema
Opzelura está indicado para el tratamiento del vitíligo no segmentario con afectación facial en adultos y adolescentes a partir de 12 años.
 4.2 - Posología y administración de OPZELURA 15 mg/g Crema
4.2 - Posología y administración de OPZELURA 15 mg/g Crema
 4.3 - Contraindicaciones de OPZELURA 15 mg/g Crema
4.3 - Contraindicaciones de OPZELURA 15 mg/g Crema
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección. 6.1. Embarazo y lactancia (ver sección 4.6).
 4.4 - Advertencias y Precauciones de OPZELURA 15 mg/g Crema
4.4 - Advertencias y Precauciones de OPZELURA 15 mg/g Crema
La crema no está indicada para un uso oftálmico, oral o intravaginal (ver sección 4.2). En caso de exposición accidental de ojos o mucosas, se debe retirar o aclarar la crema con abundante agua.
? CÁNCER DE PIEL NO MELANOMA
Se ha notificado casos de cáncer de piel no melanoma de forma predominante en carcinomas basocelulares, en pacientes tratados con ruxolitinib tópico. La mayoría de estos pacientes presentaban factores de riesgo, como fototerapia previa o cáncer de piel no melanoma previo. No se ha establecido una relación causal con ruxolitinib tópico. Se recomienda realizar análisis de la piel de manera periódica en todos los pacientes, en particular en aquellos con factores de riesgo de cáncer de piel.
? EXCIPIENTES CON EFECTO CONOCIDO
Propilenglicol
Este medicamento contiene 150 mg de propilenglicol (E1520) en cada gramo de crema, lo que puede provocar irritación en la piel.
Alcohol cetílico y alcohol estearílico
Este medicamento contiene alcohol cetílico y alcohol estearílico, lo que puede producir reacciones locales en la piel (por ejemplo, dermatitis de contacto).
Parahidroxibenzoatos
Este medicamento contiene parahidroxibenzoato de metilo (E218) y parahidroxibenzoato de propilo, lo que puede producir reacciones alérgicas (posiblemente retardadas).
Butilhidroxitolueno
Este medicamento contiene butilhidroxitolueno (E321), lo que puede producir reacciones locales en la piel (por ejemplo, dermatitis de contacto) o irritación de los ojos y membranas mucosas.
 4.5 - Interacciones con otros medicamentos de OPZELURA 15 mg/g Crema
4.5 - Interacciones con otros medicamentos de OPZELURA 15 mg/g Crema
No se han realizado estudios de interacciones con ruxolitinib administrado por vía tópica.
Las interacciones potenciales con ruxolitinib se consideran bajas debido a la limitada exposición sistémica tras la administración por vía tópica.
Según los datos in vitro, ruxolitinib es metabolizado principalmente por el citrocromo P450 3A4 (CYP3A4). Se evaluaron las interacciones potenciales para ruxolitinib oral en estudios clínicos farmacológicos específicos que incluían la administración concomitante de potentes o moderados inhibidores de CYP3A4 o un inductor potente. La concentración plasmática AUC es aproximadamente el doble con la administración concomitante de un inhibidor potente de CYP3A4, mientras que solo se observa un aumento moderado con la administración concomitante de un inhibidor moderado de CYP3A4.
No se ha evaluado el uso concomitante de ruxolitinib crema con otros medicamentos tópicos usados para tratar el vitíligo, y no se recomienda la aplicación conjunta en las mismas zonas de la piel.
La aplicación de otros medicamentos tópicos usados para tratar otras enfermedades en las mismas zonas de la piel debe realizarse un mínimo de 2 horas después de la aplicación de ruxolitinib crema. Esto también se aplica al uso de protector solar o emolientes.
 4.6 - Embarazo y Lactancia de OPZELURA 15 mg/g Crema
4.6 - Embarazo y Lactancia de OPZELURA 15 mg/g Crema
? MÉTODOS ANTICONCEPTIVOS EN MUJERES EN EDAD FÉRTIL
Las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos durante el tratamiento y hasta 4 semanas tras finalizar el tratamiento.
? EMBARAZO
No hay datos o éstos son limitados relativos al uso de ruxolitinib en mujeres embarazadas. No existen datos sobre la absorción sistémica de ruxolitinib tópico durante el embarazo. También podría haber factores individuales (por ejemplo, barrera cutánea dañada, uso excesivo) que contribuyan a un aumento de la exposición sistémica.
En estudios realizados en animales se ha demostrado que ruxolitinib resulta tóxico para el embrión y el feto tras la administración oral. No se observó teratogenia en ratas o conejos (ver sección 5.3). El uso de Opzelura está contraindicado durante el embarazo (ver sección 4.3).
? LACTANCIA
No existen datos disponibles relativos a la presencia de ruxolitinib en la leche materna, a los efectos que puede causar en lactantes o a los efectos en la producción de leche tras la aplicación tópica de Opzelura. Tras la administración oral de ruxolitinib a ratas lactantes, ruxolitinib y sus metabolitos estaban presentes en la leche con una concentración 13 veces mayor que la concentración plasmática materna. En estudios realizados en crías de rata, la administración de ruxolitinib resultó en efectos en el crecimiento y las medidas óseas (ver sección 5.3). Opzelura está contraindicado durante la lactancia (ver sección 4.3) y debe interrumpirse el tratamiento aproximadamente cuatro semanas antes del comienzo de la lactancia.
? FERTILIDAD
No hay datos disponibles relativos al efecto de ruxolitinib sobre la fertilidad en humanos. En estudios realizados en animales no se observó ningún efecto de ruxolitinib oral sobre la fertilidad.
 4.7 - Efectos sobre la capacidad de conducción de OPZELURA 15 mg/g Crema
4.7 - Efectos sobre la capacidad de conducción de OPZELURA 15 mg/g Crema
La influencia de ruxolitinib crema sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
 4.8 - Reacciones Adversas de OPZELURA 15 mg/g Crema
4.8 - Reacciones Adversas de OPZELURA 15 mg/g Crema
? RESUMEN DEL PERFIL DE SEGURIDAD
En los estudios pivotales se evaluó principalmente la seguridad durante un año. En el estudio de extensión a largo plazo (ver sección 5.1), la seguridad evaluada hasta los 2 años fue acorde al perfil notificado en los estudios pivotales. La reacción adversa más frecuente es acné en el sitio de aplicación (5,8%).
? TABLA DE REACCIONES ADVERSAS
Las reacciones adversas se clasifican según su frecuencia, siendo la primera la más frecuente, de acuerdo con las siguientes categorías: muy frecuentes (≥ 1/10); frecuentes (≥ 1/100 a < 1/10); poco frecuentes (≥ 1/1 000 a < 1/100); raras (≥ 1/10 000 a < 1/1 000); muy raras (< 1/10 000); frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Tabla 1: Reacciones adversas
| Clasificación por órganos y sistemas | Frecuencia | Reacción adversa |
| Trastornos generales y alteraciones en el lugar de administración | Frecuentes | Acné en el lugar de la aplicación |
? NOTIFICACIÓN DE SOSPECHAS DE REACCIONES ADVERSAS
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
 4.9 - Sobredosificación de OPZELURA 15 mg/g Crema
4.9 - Sobredosificación de OPZELURA 15 mg/g Crema
La sobredosis tras la administración cutánea es poco probable. Si se aplica demasiada cantidad de crema, se puede retirar el exceso.
En caso de exposición oftálmica, por mucosa oral o intravaginal accidental, se debe retirar y/o aclarar la crema con abundante agua (ver secciones 4.2 y 4.4).
 5. - PROPIEDADES FARMACOLÓGICAS
5. - PROPIEDADES FARMACOLÓGICAS
 5.1 - Propiedades farmacodinámicas de OPZELURA 15 mg/g Crema
5.1 - Propiedades farmacodinámicas de OPZELURA 15 mg/g Crema
Grupo farmacoterapéutico: otras preparaciones dermatológicas, agentes para la dermatitis, salvo los corticoesteroides, código ATC: D11AH09
? MECANISMO DE ACCIÓN
Ruxolitinib es un inhibidor selectivo de las quinasas asociadas a Janus (JAK) JAK1 y JAK2. La señalización intracelular de JAK implica la fosforilación y activación de transductores de señal y activadores de la transcripción (STAT), lo que activa la expresión genética dentro de la célula. Se cree que los linfocitos T citotóxicos productores de IFN autoinmunes son los responsables directos de la destrucción de melanocitos en el vitíligo humano. El reclutamiento de linfocitos citotóxicos en la piel lesionada está mediada a través de quimiocinas dependientes del IFN, como la CXCL10. La señalización descendente de IFN depende de JAK1/2 y el tratamiento con ruxolitinib reduce los niveles de CXCL10 en pacientes con vitíligo.
? EFICACIA CLÍNICA Y SEGURIDAD
En dos estudios aleatorizados, doble ciego, controlados con vehículo y diseñados de manera idéntica (TRuE-V1 y TRuE-V2) participaron un total de 674 pacientes con vitíligo facial y corporal total (facial y no facial) que no superaban el 10% de la SC, con una extensión inicial de la enfermedad que oscilaba entre el 3,2% y el 10,1% de la SC, de 12 años o más (el 10,7% de los pacientes tenían entre 12 y 17 años y el 6,7%, 65 años o más). El 53,1% de los pacientes eran mujeres, el 81,9% eran blancos, el 4,7% eran negros y el 4,2%, asiáticos. La mayoría de los pacientes presentaban los tipos de piel III, IV, V, o VI (67,5%) según la escala Fitzpatrick.En ambos estudios, se asignaron los pacientes de forma aleatoria en una proporción de 2:1 al tratamiento con ruxolitinib crema o con vehículo dos veces al día durante 24 semanas con una SC afectada que no superaba el 10%, seguido de 28 semanas adicionales de tratamiento con ruxolitinib crema dos veces al día para todos los pacientes. La variable de eficacia principal fue la proporción de pacientes que lograron una repigmentación del 75% en el índice de puntuación del área de vitíligo facial (F-VASI75) en la semana 24. Las variables secundarias principales incluían las proporciones de pacientes que lograron una repigmentación del 90% en F-VASI (F-VASI90), una mejora del 50% en el índice de puntuación del área de vitíligo corporal total (T-VASI50) y una puntuación en la escala de notoriedad del vitíligo (VNS) de 4 o 5 (vitíligo “mucho menos perceptible” o “ya no perceptible”).
En ambos estudios se observó la repigmentación de las lesiones de vitíligo tratadas y la superioridad de ruxolitinib crema sobre la crema vehículo, tal como lo demuestran las diferencias estadísticamente significativas en las tasas de respuesta para F-VASI75/90, T-VASI50 y la puntuación en la VNS de 4 o 5 en la semana 24 (Tabla 2).
La diferencia entre el efecto del tratamiento y del vehículo se observa numéricamente ya en la semana 12. Se observó una repigmentación continuada según lo evaluado por las puntuaciones de VASI y VNS en la semana 52 en aquellos pacientes que habían aplicado ruxolitinib crema dos veces al día de forma continua desde el inicio. En la Figura 1 se muestra la proporción de pacientes que lograron F-VASI75 durante el periodo de tratamiento de 52 semanas en los datos agrupados de los estudios TRuE-V1 y TRuE-V2.
Se observan respuestas de tratamiento similares en la semana 52 en aquellos pacientes que pasaron del vehículo a ruxolitinib (Figura 1).
Tabla 2: Porcentaje de pacientes con vitíligo que alcanzaron las variables primarias y secundarias principales en la semana 24 (intención de tratar)a
| Porcentaje de pacientes con vitíligo que alcanzaron las variables primarias y secundarias principales en la semana 24 (intención de tratar)a | ||||
| TRuE-V1 | TRuE-V2 | |||
| Opzelura | Vehículo | Opzelura | Vehículo | |
| (N = 221) | (N = 109) | (N = 222) | (N = 109) | |
| F-VASI75 (%) | 29,8 | 7,4 | 30,9 | 11,4 |
| Diferencia de tasas de respuesta (IC del 95%) | 22,3b (14,214, 30,471) | - | 19,5c (10,537, 28,420) | - |
| F-VASI90 (%) | 15,3 | 2,2 | 16,3 | 1,3 |
| Diferencia de tasas de respuesta (IC del 95%) | 13,2d (7,497, 18,839) | - | 15,0e (9,250, 20,702) | - |
| T-VASI50 (%) | 20,6 | 5,1 | 23,9 | 6,8 |
| Diferencia de tasas de respuesta (IC del 95%) | 15,5d (8,339, 22,592) | - | 17,1c (9,538, 24,721) | - |
| 4 o 5 en VNS (%) | 24,5 | 3,3 | 20,5 | 4,9 |
| Diferencia de tasas de respuesta (IC del 95%) | 21,2c (14,271, 28,143) | - | 15,5d (8,515, 22,561) | - |
a: Se corrigieron los resultados primarios y secundarios principales usando el método de imputación múltiple;
b: valor de p < 0,0001; c: valor de p < 0,001; d: valor de p < 0,005; e: valor de p < 0,01
Figura 1: Proporción de pacientes que lograron F-VASI75 durante el periodo de tratamiento de 52 semanas (intención de tratar): datos agrupados de los estudios TRuE-V1 y TRuE-V2
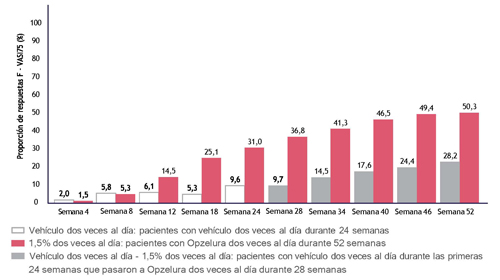
En la semana 52, la tasa de respuesta observada para F-VASI90, T-VASI50 y VNS fue del 30,3%, 51,1% y 36,3%, respectivamente, para la población ITT agrupada.
Durabilidad de la respuesta
En un estudio de fase 3, doble ciego, controlado con vehículo, aleatorizado, de retirada y extensión del tratamiento con ruxolitinib crema dos veces al día participaron 458 pacientes aptos con vitíligo que habían finalizado uno de los estudios principales con ruxolitinib (TRuE-V1 y TRuE-V2; semana 52); los pacientes fueron asignados a la cohorte A o B con un seguimiento hasta 104 semanas.
La cohorte A estaba compuesta por 116 pacientes que alcanzaron ≥ F-VASI90 en la semana 52 del estudio principal. A estos pacientes se les volvió a aleatorizar a ruxolitinib o al vehículo (es decir, se les retiró el tratamiento) para estudiar la recaída (< F-VASI75). La recaída se observó en el 15 % de los pacientes del grupo con ruxolitinib y en el 29 % de los pacientes del grupo con vehículo. En este último, la mayoría de las recaídas (9/16) se produjeron en los primeros 4 meses tras la interrupción del tratamiento con ruxolitinib crema. De los 16 pacientes del grupo con vehículo que recayeron y a los que se les reinició el tratamiento, 12 (75 %) lograron recuperar F-VASI75 en una mediana de 12 semanas, mientras que 11 pacientes (69 %) recuperaron F-VASI90 en una mediana de 15 semanas. La cohorte B estaba compuesta por 342 pacientes que alcanzaron < F-VASI90 en la semana 52 del estudio principal. Estos pacientes continuaron con el tratamiento con ruxolitinib en abierto. En la semana 104, de los pacientes a los que se les aleatorizó originalmente a ruxolitinib crema dos veces al día, el 66 % alcanzó F-VASI75 y el 34 %, F-VASI90.
? POBLACIÓN PEDIÁTRICA
En los estudios pivotales para el registro se incluyó a un total de 72 adolescentes (de 12 a < 18 años; n = 55 ruxolitinib crema, n = 17 vehículo). Los adolescentes que recibieron ruxolitinib mostraron unas tasas de respuesta iguales en las variables primarias y secundarias principales a las 24 semanas en comparación con los adultos de 18 a 65 años.
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Opzelura en uno o más subgrupos de la población pediátrica para el tratamiento del vitíligo (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
 5.2 - Propiedades farmacocinéticas de OPZELURA 15 mg/g Crema
5.2 - Propiedades farmacocinéticas de OPZELURA 15 mg/g Crema
ABSORCIÓN
Se analizaron las propiedades farmacocinéticas de ruxolitinib crema en 429 sujetos con vitíligo de 12 años de edad y mayores (el 12,6% de los sujetos tenía entre 12 y 17 años) con una afectación de la SC media de 7,31±2,02% de desviación estándar (rango de 3,2% a 10,0%). Los sujetos se aplicaron aproximadamente 1,58 mg/cm2 de ruxolitinib crema (el intervalo de dosis fue de aproximadamente de 0,18 a 8,4 gramos de ruxolitinib crema por aplicación) dos veces al día durante 24 semana en las mismas zonas de la piel.
La media de las concentraciones plasmáticas en estado estacionario fue de 56,9 nM con una desviación estándar de ±62,6 nM con un AUC 0-12 h proyectada de 683 ± 751 h*nM lo cual es aproximadamente el 25% del AUC 0-12h medio observado en estado estacionario [2716 h*nM] tras la administración oral de 15 mg dos veces al día en voluntarios sanos. La biodisponibilidad tópica media (media geométrica) de ruxolitinib crema en participantes con vitíligo en los datos agrupados de los dos estudios de fase 3 fue del 9,72% (5,78%).
? DISTRIBUCIÓN
Según un estudio in vitro, ruxolitinib se une en un 97% a las proteínas plasmáticas humanas, principalmente a la albúmina.
? BIOTRANSFORMACIÓN
Ruxolitinib es metabolizado por el CYP3A4, y por el CYP2C9 en menor medida.
? ELIMINACIÓN
La semivida de eliminación media de ruxolitinib administrado por vía oral es de aproximadamente 3 horas. La semivida media terminal aparente de ruxolitinib tras la aplicación tópica se estimó en 9 pacientes adultos y adolescentes con una afectación ≥ 25% de la SC con dermatitis atópica es de, aproximadamente, 116 horas, lo que refleja la lenta velocidad de absorción del fármaco más que su velocidad de eliminación.
? POBLACIONES ESPECIALES
Insuficiencia renal
El AUC estimado y ajustado para la actividad farmacológica de ruxolitinib junto con los metabolitos se duplica, aproximadamente, en caso de enfermedad renal terminal. Como medida de precaución, los pacientes con enfermedad renal terminal no deben utilizar ruxolitinib crema debido a la falta de información sobre su seguridad.
Insuficiencia hepática
Aunque el AUC aumentó tras la administración oral de ruxolitinib en pacientes con insuficiencia hepática, no se observó una relación clara entre la gravedad de la insuficiencia hepática y el aumento del AUC. No es necesario hacer recomendaciones de dosificación para pacientes con insuficiencia hepática.
 5.3 - Datos preclínicos sobre seguridad de OPZELURA 15 mg/g Crema
5.3 - Datos preclínicos sobre seguridad de OPZELURA 15 mg/g Crema
Se ha evaluado ruxolitinib en estudios farmacológicos de seguridad, toxicidad de dosis repetidas, genotoxicidad y toxicidad de la reproducción, y de carcinogenicidad tras la administración oral. Se realizaron estudios adicionales tras la administración dérmica en cerdos minipigs y ratones. Entre los órganos afectados por la acción farmacológica de ruxolitinib en estudios orales de dosis repetida se incluyen la médula ósea, la sangre periférica y los tejidos linfáticos. En perros se observaron infecciones generalmente asociadas con inmunosupresión. Los márgenes (basados en el AUC de la fracción libre) en los que no se produjeron efectos adversos en los estudios de toxicidad crónica fueron, aproximadamente, 6 y 200 veces mayores en ratas macho y hembra, y 10 veces mayores en perros que la exposición sistémica observada en pacientes con vitíligo que se aplicaban ruxolitinib crema al 1,5% dos veces al día. En un estudio de telemetría realizado en perros se observaron descensos adversos de la presión arterial junto con aumentos del ritmo cardiaco, y en un estudio respiratorio realizado en ratas se observó una disminución del volumen respiratorio por minuto. Los márgenes (basados en Cmáx de la fracción libre) en los que no se produjeron efectos adversos en los estudios realizados en perros y ratas fueron, aproximadamente, 300 y 100 veces mayores, respectivamente, que la exposición sistémica observada en pacientes con vitíligo que se aplicaban ruxolitinib crema al 1,5% dos veces al día. En una evaluación de los efectos neurofarmacológicos del ruxolitinib, no se observó ningún efecto adverso en ratas.
Un estudio de administración dérmica repetida de 3 meses de duración reveló una disminución del recuento de linfocitos en ratones. Los márgenes (basados en el AUC de la fracción libre) en los que no se produjeron efectos adversos fueron, aproximadamente, 10 veces mayores en ratones macho y 24 veces mayores en ratones hembra que la exposición sistémica observada en pacientes con vitíligo que se aplicaban ruxolitinib crema al 1,5% dos veces al día. También se observó una disminución no adversa de los recuentos de linfocitos periféricos en cerdos minipigs en un estudio de toxicidad dérmica de 9 meses de duración. Los márgenes (basados en el AUC de la fracción libre) en los que no se produjeron efectos adversos fueron, aproximadamente, 3 veces mayores en cerdos minipigs que la exposición sistémica observada en pacientes con vitíligo que se aplicaban ruxolitinib crema al 1,5% dos veces al día. Este efecto no se observó en ningún estudio de toxicidad dérmica de 3 meses de duración realizado en cerdos minipigs. No se observaron indicios de toxicidad sistémica en cerdos minipigs de Göttingen tras la administración tópica de la formulación en crema de ruxolitinib al 1,5% dos veces al día durante 9 meses.En estudios realizados en crías de rata, la administración de ruxolitinib resultó en efectos en el crecimiento y las medidas óseas. Se observó una reducción del crecimiento óseo con dosis ≥ 5 mg/kg/día al iniciar el tratamiento 7 días después del nacimiento (comparable al recién nacido humano) y con dosis ≥ 15 mg/kg/día al iniciar el tratamiento 14 o 21 días después del nacimiento (comparable a un bebé humano de entre 1 y 3 años). Al iniciar el tratamiento 7 días después del nacimiento con dosis ≥ 30 mg/kg/día, se observaron fracturas y una interrupción temprana del desarrollo de las ratas. Según el AUC de la fracción libre, la exposición a niveles sin efecto adverso observado en crías de rata tratadas a partir del día 7 tras el nacimiento fue, aproximadamente, 20 veces mayor que la observada en pacientes adultos con vitíligo, mientras que las exposiciones a las que aparecieron la reducción del crecimiento óseo y las fracturas fueron 22 y 150 veces mayores, respectivamente, que las observadas en pacientes adultos con vitíligo. Los efectos tras el nacimiento fueron generalmente más graves en machos cuando la administración se inició antes. Aparte del desarrollo óseo, los efectos de ruxolitinib en crías de rata fueron similares a los de las ratas adultas. Las crías de rata son más sensibles a la toxicidad de ruxolitinib que las ratas adultas.
La administración oral de ruxolitinib en ratas y conejos durante la gestación disminuyó el peso del feto y aumentó las pérdidas post-implantación en dosis asociadas con la toxicidad materna en estudios de desarrollo embriofetal. No se observaron indicios de efectos teratógenos en ratas ni en conejos. Los márgenes (basados en el AUC de la fracción libre) en los que no se produjeron efectos adversos para la toxicidad del desarrollo en ratas fueron, aproximadamente, 25 veces mayores que la exposición sistémica observada en pacientes con vitíligo que se aplicaban ruxolitinib crema al 1,5% dos veces al día. No se observaron efectos de ruxolitinib oral sobre la fertilidad en ratas macho o hembra. En un estudio sobre desarrollo pre y posnatal, se observaron unos periodos de gestación ligeramente prolongados, además de un número reducido de lugares de implantación y de crías. En las crías, se observó una disminución del peso corporal medio inicial y, durante un corto periodo de tiempo, una disminución del promedio del aumento de peso. En ratas lactantes, ruxolitinib o sus metabolitos se secretaban en la leche con una concentración 13 veces mayor que la concentración plasmática materna. Ruxolitinib no fue mutágeno ni clastógeno. Ruxolitinib no mostró ningún potencial carcinógeno tras su administración tópica en ratones ni tras su administración oral en ratas albinas y ratones Tg.rasH2.
 6. - DATOS FARMACÉUTICOS
6. - DATOS FARMACÉUTICOS
 6.1 - Lista de excipientes de OPZELURA 15 mg/g Crema
6.1 - Lista de excipientes de OPZELURA 15 mg/g Crema
- Butilhidroxitolueno (como antioxidante en parafina blanca) (E321)
- Alcohol cetílico
- Dimeticona (E900)
- Edetato disódico (E385)
- Estearato de glicerilo autoemulsionante
- Macrogol
- Triglicéridos de cadena media
- Parahidroxibenzoato de metilo (E218)
- Parafina (E905), líquida ligera
- Parafina (E905), blanca
- Fenoxietanol
- Polisorbato 20 (E432)
- Propilenglicol (E1520)
- Parahidroxibenzoato de propilo
- Agua purificada
- Alcohol estearílico
- Goma xantana (E415)
 6.2 - Incompatibilidades de OPZELURA 15 mg/g Crema
6.2 - Incompatibilidades de OPZELURA 15 mg/g Crema
No procede
 6.3 - Período de validez de OPZELURA 15 mg/g Crema
6.3 - Período de validez de OPZELURA 15 mg/g Crema
21 meses
Después de la primera apertura: 6 meses.
 6.4 - Precauciones especiales de conservación de OPZELURA 15 mg/g Crema
6.4 - Precauciones especiales de conservación de OPZELURA 15 mg/g Crema
No conservar a temperatura superior a 30 °C.
 6.5 - Naturaleza y contenido del recipiente de OPZELURA 15 mg/g Crema
6.5 - Naturaleza y contenido del recipiente de OPZELURA 15 mg/g Crema
Tubo laminado con un revestimiento interno de polietileno de baja y alta densidad, provisto de una cápsula de cierre de polipropileno, o tubo de aluminio con lacado interior y cápsula de cierre de polipropileno con punzón.
Tubo de 100 g. Un tubo en cada caja.
 6.6 - Precauciones especiales de eliminación y otras manipulaciones de OPZELURA 15 mg/g Crema
6.6 - Precauciones especiales de eliminación y otras manipulaciones de OPZELURA 15 mg/g Crema
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
 7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Incyte Biosciences Distribution B.V.
Paasheuvelweg 25
1105 BP Ámsterdam
Países Bajos
 8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/23/1726/001
EU/1/23/1726/002
 9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 19/abril/2023
 10. - FECHA DE LA REVISIÓN DEL TEXTO
10. - FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN.
Financiado por el Sistema Nacional de Salud. Medicamento sujeto a prescripción médica. Diagnóstico hospitalario. Reservas singulares en el ámbito del Sistema Nacional de Salud, consistente en limitar su dispensación, sin necesidad de visado, a los pacientes no hospitalizados en los Servicios de Farmacia o centros sanitarios autorizados del SNS. Opzelura 15 mg/g crema, 1 tubo de 100 g (aluminio) (C.N. 762978.8). Opzelura 15 mg/g crema, tubo de 100 g (laminado) (C.N. 764336.4). PRECIO INDUSTRIAL NOTIFICADO 750 €.

