VERZENIOS 50 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
| ATC: Abemaciclib |
| PA: Abemaciclib |
| EXC: Lactosa monohidrato y otros. |
Envases
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
3. - FORMA FARMACÉUTICA
4. - DATOS CLÍNICOS
5. - PROPIEDADES FARMACOLÓGICAS
6. - DATOS FARMACÉUTICOS
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
10. - FECHA DE LA REVISIÓN DEL TEXTO
 1. - NOMBRE DEL MEDICAMENTO
1. - NOMBRE DEL MEDICAMENTO
VERZENIOS 50 mg Comp. recub. con película
 2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Verzenios 50 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 50 mg de abemaciclib.
Excipientes con efecto conocido
Cada comprimido recubierto con película contiene 14 mg de lactosa monohidrato.
Verzenios 100 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 100 mg de abemaciclib.
Excipientes con efecto conocido
Cada comprimido recubierto con película contiene 28 mg de lactosa monohidrato.
Verzenios 150 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 150 mg de abemaciclib.
Excipientes con efecto conocido
Cada comprimido recubierto con película contiene 42 mg de lactosa monohidrato.
Para consultar la lista completa de excipientes, ver sección 6.1.
 3. - FORMA FARMACÉUTICA
3. - FORMA FARMACÉUTICA
Comprimido recubierto con película (comprimido).
Verzenios 50 mg comprimidos recubiertos con película
Comprimido beige, ovalado de 5,2 x 9,5 mm, grabado con “Lilly” en una cara y “50” en la otra.
Verzenios 100 mg comprimidos recubiertos con película
Comprimido blanco, ovalado de 6,6 x 12,0 mm, grabado con “Lilly” en una cara y “100” en la otra.
Verzenios 150 mg comprimidos recubiertos con película
Comprimido amarillo, ovalado de 7,5 x 13,7 mm, grabado con “Lilly” en una cara y “150” en la otra.
 4. - DATOS CLÍNICOS
4. - DATOS CLÍNICOS
 4.1 - Indicaciones Terapéuticas de VERZENIOS 50 mg Comp. recub. con película
4.1 - Indicaciones Terapéuticas de VERZENIOS 50 mg Comp. recub. con película
Cáncer de mama en estadios iniciales
Verzenios en combinación con hormonoterapia está indicado para el tratamiento adyuvante de pacientes adultos con cáncer de mama en estadios iniciales, positivo para el receptor hormonal (HR) y negativo para el receptor 2 del factor de crecimiento epidérmico humano (HER2), con afectación ganglionar o elevado riesgo de recidiva (ver sección 5.1).
En mujeres pre o perimenopáusicas, la hormonoterapia con inhibidores de la aromatasa se debe combinar con un agonista de la hormona liberadora de la hormona luteinizante (LHRH).
Cáncer de mama localmente avanzado o metastásico
Verzenios está indicado para el tratamiento de mujeres con cáncer de mama localmente avanzado o metastásico, positivo para el receptor hormonal (HR) y negativo para el receptor 2 del factor de crecimiento epidérmico humano (HER2), en combinación con un inhibidor de la aromatasa o fulvestrant como hormonoterapia inicial o en mujeres que hayan recibido hormonoterapia previa.
En mujeres pre o perimenopáusicas la hormonoterapia se debe combinar con un agonista de LHRH.
 4.2 - Posología y administración de VERZENIOS 50 mg Comp. recub. con película
4.2 - Posología y administración de VERZENIOS 50 mg Comp. recub. con película
 4.3 - Contraindicaciones de VERZENIOS 50 mg Comp. recub. con película
4.3 - Contraindicaciones de VERZENIOS 50 mg Comp. recub. con película
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 4.4 - Advertencias y Precauciones de VERZENIOS 50 mg Comp. recub. con película
4.4 - Advertencias y Precauciones de VERZENIOS 50 mg Comp. recub. con película
Neutropenia
Se notificó neutropenia en pacientes que estaban recibiendo abemaciclib. Se recomienda una modificación de la dosis para pacientes que desarrollen neutropenia Grado 3 o 4 (ver sección 4.2). Se produjeron casos mortales de sepsis neutropénica en < 1 % de los pacientes con cáncer de mama metastásico. Se debe indicar a los pacientes que comuniquen cualquier episodio de fiebre a su profesional sanitario.
Infecciones/infestaciones
Se notificó una mayor proporción de infecciones en pacientes que estaban recibiendo abemaciclib con hormonoterapia que en pacientes tratados con hormonoterapia sola. Se notificó infección pulmonar en pacientes que estaban recibiendo abemaciclib sin neutropenia concomitante. Se produjeron casos mortales en < 1 % de los pacientes con cáncer de mama metastásico.
Se debe monitorizar estrechamente la presencia de signos y síntomas de infección en los pacientes, así como administrarles un tratamiento médico apropiado.
Tromboembolismo venoso
Se notificaron casos de tromboembolismo venoso en pacientes tratados con abemaciclib junto con hormonoterapia. Se debe monitorizar estrechamente la presencia de signos y síntomas de tromboembolismo venoso profundo y embolismo pulmonar en los pacientes, así como administrar un tratamiento médico apropiado. Se puede requerir una modificación de la dosis de abemaciclib según el grado de TEV (ver sección 4.2).
Aumento de aminotransferasas
Se comunicaron aumentos de la ALT y AST en pacientes que estaban recibiendo abemaciclib. Se puede requerir una modificación de la dosis o la suspensión de abemaciclib según el nivel de elevación de ALT o AST (ver sección 4.2).
Diarrea
La reacción adversa más frecuente es la diarrea. A lo largo de los ensayos clínicos, la mediana de tiempo hasta la aparición de la primera diarrea fue de 6 a 8 días aproximadamente, y la duración media de la diarrea fue de 7 a 12 días (Grado 2) y de 5 a 8 días (Grado 3). La diarrea puede asociarse con deshidratación. Los pacientes deben empezar el tratamiento con un agente antidiarreico como loperamida al primer signo de heces blandas, aumentar los fluidos orales y notificarlo a sus profesionales sanitarios. Se recomienda una modificación de la dosis para pacientes que desarrollen diarrea ≥ Grado 2 (ver sección 4.2).
EPI/Neumonitis
Se han notificado casos de EPI/neumonitis en pacientes que estaban recibiendo abemaciclib. Se debe monitorizar a los pacientes por síntomas que indiquen EPI/neumonitis y administrar un tratamiento médico apropiado.
En base al grado de EPI/neumonitis, se puede requerir un ajuste de dosis de abemaciclib (ver sección 4.2). Discontinuar permanentemente el tratamiento con abemaciclib en los pacientes con EPI/neumonitis Grado 3 o 4.
Tratamiento concomitante con inductores del CYP3A4
Se debe evitar el uso concomitante de inductores del CYP3A4 debido al riesgo de disminuir la eficacia de abemaciclib (ver sección 4.5).
Crisis visceral
No existen datos sobre la eficacia y seguridad de abemaciclib en pacientes con crisis visceral.
Lactosa
Los pacientes con intolerancia hereditaria a galactosa, deficiencia total de lactasa o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
Sodio
Este medicamento contiene menos de 1 mmol (23 mg) de sodio por comprimido; esto es esencialmente “exento de sodio”.
 4.5 - Interacciones con otros medicamentos de VERZENIOS 50 mg Comp. recub. con película
4.5 - Interacciones con otros medicamentos de VERZENIOS 50 mg Comp. recub. con película
Efectos de otros medicamentos sobre la farmacocinética de abemaciclib
Abemaciclib se metaboliza principalmente por el CYP3A4.
Inhibidores CYP3A4
La administración conjunta de abemaciclib con inhibidores CYP3A4 puede aumentar las concentraciones en plasma de abemaciclib. En pacientes con cáncer avanzado y/o metastásico, la administración conjunta del inhibidor CYP3A4 claritromicina dio como resultado un incremento de 3,4 veces la exposición en plasma de abemaciclib y un incremento de 2,5 veces la potencia combinada ajustada en plasma de abemaciclib y sus metabolitos activos libres.
Se debe evitar el uso de inhibidores potentes de CYP3A4 junto a abemaciclib. Si es necesario administrar de forma conjunta inhibidores potentes de CYP3A4, se debe reducir la dosis de abemaciclib (ver sección 4.2), seguido de una estrecha monitorización de la toxicidad. Ejemplos de inhibidores potentes de CYP3A4 incluyen, entre otros: claritromicina, itraconazol, ketoconazol, lopinavir/ritonavir, posaconazol o voriconazol. Evitar el pomelo o el zumo de pomelo.
No es necesario un ajuste de dosis para pacientes tratados con un inhibidor CYP3A4 moderado o débil. Sin embargo, se debe realizar una estrecha monitorización de los signos de toxicidad.
Inductores CYP3A4
La administración conjunta de abemaciclib con el inductor potente de CYP3A4 rifampicina disminuyó la concentración en plasma de abemaciclib en un 95 % y la concentración ajustada en plasma de abemaciclib y sus metabolitos activos libres en un 77 % de acuerdo al AUC0-∞. Se debe evitar el uso concomitante de un inductor potente de CYP3A4 (incluyendo, entre otros: carbamazepina, fenitoína, rifampicina y Hierba de San Juan) debido al riesgo de disminuir la eficacia de abemaciclib.
Efectos de abemaciclib sobre la farmacocinética de otros medicamentos
Sustancias que son sustratos de transportadores
Abemaciclib y sus principales metabolitos activos inhiben los transportadores renales: transportador de cationes orgánicos 2 (organic cation transporter 2, OCT2, por sus siglas en inglés), proteína de extrusión de toxinas y múltiples drogas (MATE1) y MATE2-K. Pueden ocurrir interacciones in vivo clínicamente relevantes de abemaciclib con sustratos de estos transportadores, como dofetilida o creatinina (ver sección 4.8). En un estudio clínico de interacción de fármacos con metformina (sustrato de OCT2, MATE1 y 2) administrado conjuntamente con 400 mg de abemaciclib, se observó un pequeño aumento, pero no clínicamente relevante (37 %) en la exposición de metformina en plasma. Se observó que esto era debido a la reducción de la secreción renal sin afectación de la filtración glomerular.
En sujetos sanos, la administración conjunta de abemaciclib y loperamida, sustrato de la glicoproteína P (P-gp), dio como resultado un aumento de la exposición de loperamida en plasma del 9 % basada en el AUC0-∞ y del 35 % basado en la Cmax. Esto no se consideró clínicamente relevante. Sin embargo, de acuerdo a la inhibición in vitro de la P-gp y la proteína de resistencia al cáncer de mama (breast cancer resistance protein, BCRP, por sus siglas en inglés) observada con abemaciclib, pueden ocurrir interacciones in vivo de abemaciclib con sustratos con estrecho margen terapéutico de estos transportadores, como digoxina o dabigatrán etexilato.
En un estudio clínico en pacientes con cáncer de mama, no hubo interacción farmacocinética clínicamente relevante entre abemaciclib y anastrozol, fulvestrant, exemestano, letrozol o tamoxifeno.
Se desconoce actualmente si abemaciclib puede reducir la eficacia de los anticonceptivos hormonales de acción sistémica.
 4.6 - Embarazo y Lactancia de VERZENIOS 50 mg Comp. recub. con película
4.6 - Embarazo y Lactancia de VERZENIOS 50 mg Comp. recub. con película
Mujeres en edad fértil/Anticoncepción
Las mujeres en edad fértil deben utilizar métodos anticonceptivos altamente efectivos (por ejemplo, contracepción de doble barrera) durante el tratamiento y hasta al menos 3 semanas tras finalizar el tratamiento (ver sección 4.5).
Embarazo
No hay datos relativos al uso de abemaciclib en mujeres embarazadas. Los estudios realizados en animales han mostrado toxicidad para la reproducción (ver sección 5.3). No se recomienda tomar Verzenios durante el embarazo, ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos.
Lactancia
Se desconoce si abemaciclib se excreta en la leche materna. No se puede excluir un riesgo en los niños lactantes. Las pacientes que tomen abemaciclib no deben dar el pecho.
Fertilidad
Se desconoce el efecto de abemaciclib sobre la fertilidad en humanos. A pesar de que en ratas no se observaron efectos sobre la fertilidad en machos, los efectos citotóxicos en el aparato reproductor en ratones, ratas y perros machos indican que abemaciclib puede afectar la fertilidad en los machos. No se observaron efectos adversos sobre los órganos reproductores en ratones, ratas o perros hembras, ni efectos sobre la fertilidad en hembras y el desarrollo embrionario temprano en ratas (ver sección 5.3).
 4.7 - Efectos sobre la capacidad de conducción de VERZENIOS 50 mg Comp. recub. con película
4.7 - Efectos sobre la capacidad de conducción de VERZENIOS 50 mg Comp. recub. con película
La influencia de Verzenios sobre la capacidad para conducir y utilizar máquinas es pequeña. Se debe advertir a los pacientes que tengan precaución al conducir o utilizar máquinas en caso de presentar fatiga o mareos durante el tratamiento con Verzenios (ver sección 4.8).
 4.8 - Reacciones Adversas de VERZENIOS 50 mg Comp. recub. con película
4.8 - Reacciones Adversas de VERZENIOS 50 mg Comp. recub. con película
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes son diarrea, infecciones, neutropenia, leucopenia, anemia, fatiga, náuseas, vómitos, alopecia y disminución del apetito.
De las reacciones adversas más comunes, los eventos de grado ≥ 3 fueron inferiores al 5 %, a excepción de la neutropenia, leucopenia y diarrea.
Tabla de reacciones adversas
En la siguiente Tabla, se listan las reacciones adversas de acuerdo a la clasificación por órganos y sistemas y frecuencia de MedDRA. Los grados de frecuencia son: muy frecuentes (≥ 1 / 10), frecuentes (≥ 1 / 100 a < 1 / 10), poco frecuentes (≥ 1 / 1000 a < 1 / 100), raras (≥ 1 / 10 000 a < 1 / 1000), muy raras (< 1 / 10 000), y frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden de gravedad decreciente.
Tabla 8. Reacciones adversas notificadas en estudios fase 3 de abemaciclib en combinación con hormonoterapiaa (N = 3559)
| Clasificación por órganos y sistemas | Muy frecuentes | Frecuentes | Poco frecuentes |
| Infecciones e infestaciones | Infecciones b | ||
| Trastornos de la sangre y del sistema linfático | Neutropenia Leucopenia Anemia Trombocitopenia Linfopenia h | Neutropenia febril e | |
| Trastornos del metabolismo y de la nutrición | Apetito disminuido | ||
| Trastornos del sistema nervioso | Dolor de cabeza f Disgeusia g Mareos g | ||
| Trastornos oculares | Aumento de lagrimeo | ||
| Trastornos vasculares | Tromboembolismo venoso c | ||
| Trastornos respiratorios, torácicos y mediastínicos | EPI/neumonitis d | ||
| Trastornos gastrointestinales | Diarrea Vómitos Náuseas Estomatitis f | Dispepsia f | |
| Trastornos de la piel y del tejido subcutáneo | Alopecia g Prurito g Erupción g | Alteración de las uñas f Piel seca e | |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Debilidad muscular e | ||
| Trastornos generales y alteraciones en el lugar de administración | Pirexia e Fatiga | ||
| Exploraciones complementarias | Alanina aminotransferasa elevada g Aspartato aminotransferasa elevada g |
a Abemaciclib en combinación con anastrozol, letrozol, exemestano, tamoxifeno o fulvestrant.
b Infecciones incluye todos los términos preferentes (PTs por sus siglas en inglés) que son parte de la clasificación por órganos y sistemas infecciones e infestaciones.
c Eventos tromboembólicos venosos incluye: trombosis venosa profunda (deep vein thrombosis, DVT, por sus siglas en inglés), embolismo pulmonar, trombosis del seno venoso cerebral, subclavia, trombosis de la vena axilar, DVT de vena cava inferior y trombosis venosa pélvica.
d EPI/neumonitis para el cáncer de mama en estadios iniciales (early breast cancer, EBC, por sus siglas en inglés) incluye todos los términos preferentes que son parte de la consulta normalizada MedDRA (SMQ, por sus siglas en inglés) en la enfermedad pulmonar intersticial. Para el cáncer de mama metastásico (metastasic breast cancer, mBC, por sus siglas en inglés), los términos preferentes incluyen enfermedad pulmonar intersticial, neumonitis, neumonía organizativa, fibrosis pulmonar y bronquiolitis obliterante.
e RAMs consideradas en el entorno mBC únicamente (MONARCH 2 y MONARCH 3).
f RAMs consideradas en el entorno EBC únicamente (monarchE).
g Frecuentes en el entorno EBC (monarchE), muy frecuentes en el entorno mBC (MONARCH 2 y MONARCH 3).
h Frecuentes en el entorno mBC (MONARCH 2 y MONARCH 3), muy frecuentes en el entorno EBC (monarchE)
Descripción de reacciones adversas seleccionadas
Neutropenia
Se notificó neutropenia frecuentemente en todos los estudios. En el estudio monarchE, se notificó neutropenia en el 45,8 % de los pacientes. Se notificó una disminución en el recuento de neutrófilos de Grado 3 o 4 (basado en hallazgos de laboratorio) en el 19,1 % de los pacientes que recibieron abemaciclib en combinación con hormonoterapia con una mediana de tiempo hasta la aparición de 30 días y una mediana de tiempo hasta la resolución de 16 días. Se notificó neutropenia febril en el 0,3 % de los pacientes. En los estudios MONARCH 2 y MONARCH 3, se notificó neutropenia en el 45,1 % de los pacientes. Se notificó una disminución en el recuento de neutrófilos de Grado 3 o 4 (basado en hallazgos de laboratorio) en el 28,2 % de los pacientes que recibieron abemaciclib en combinación con un inhibidor de la aromatasa o fulvestrant. La mediana de tiempo hasta la aparición de neutropenia de Grado 3 o 4 fue de 29 a 33 días, y la mediana de tiempo hasta la resolución fue de 11 a 15 días. Se notificó neutropenia febril en el 0,9 % de los pacientes. Se recomienda una modificación de la dosis para pacientes que desarrollen neutropenia Grado 3 o 4 (ver sección 4.2).
Diarrea
La diarrea fue la reacción adversa notificada con más frecuencia (ver Tabla 8). La incidencia fue mayor durante el primer mes de tratamiento con abemaciclib y fue disminuyendo posteriormente. En el estudio monarchE, la mediana de tiempo hasta la aparición del primer episodio de diarrea de cualquier grado fue de 8 días. La duración media de la diarrea Grado 2 fue de 7 días y de 5 días para la diarrea Grado 3. En los estudios MONARCH 2 y MONARCH 3, la mediana de tiempo hasta la aparición del primer episodio de diarrea de cualquier grado fue aproximadamente de 6 a 8 días. La duración media fue de 9 a 12 días para las diarreas Grado 2 y de 6 a 8 días para las de Grado 3. La diarrea volvió a la situación inicial o a un Grado menor con tratamiento de soporte como loperamida y/o ajuste de dosis (ver sección 4.2).
Aumento de aminotransferasas
En el estudio monarchE, se notificaron frecuentemente elevaciones de ALT y AST (12,3 % y 11,8 %, respectivamente) en pacientes que recibieron abemaciclib en combinación con hormonoterapia. Se notificaron elevaciones de ALT o AST de Grado 3 o 4 (basado en hallazgos de laboratorio) en el 2,6 % y el 1,6 % de los pacientes. La mediana de tiempo hasta la aparición de la elevación de ALT de Grado 3 o 4 fue de 118 días, y la mediana de tiempo hasta la resolución fue de 14,5 días. La mediana de tiempo hasta la aparición de la elevación de AST de Grado 3 o 4 fue de 90,5 días y la mediana de tiempo hasta la resolución fue de 11 días. En los estudios MONARCH 2 y MONARCH 3, se notificaron frecuentemente elevaciones de ALT y AST (15,1 % y 14,2 %, respectivamente) en pacientes que recibieron abemaciclib en combinación con un inhibidor de aromatasa o fulvestrant. Se notificaron elevaciones de ALT o AST de Grado 3 o 4 (basado en hallazgos de laboratorio) en el 6,1 % y el 4,2 % de los pacientes. La mediana de tiempo hasta la aparición de un aumento de ALT de Grado 3 o 4 fue de 57 a 61 días, y la mediana de tiempo hasta la resolución fue de 14 días. La mediana de tiempo hasta la aparición de un aumento de Grado 3 o 4 de AST fue de 71 a 185 días, y la mediana de tiempo hasta la resolución fue de 13 a 15 días. Se recomienda modificación de la dosis para pacientes que desarrollen elevaciones de ALT o AST de Grado 3 o 4 (ver sección 4.2).
Creatinina
Aunque no es una reacción adversa, se ha demostrado que abemaciclib aumenta la creatinina sérica. En el estudio monarchE, el 99,3 % de los pacientes presentaron elevaciones de la creatinina sérica (basado en hallazgos de laboratorio), y de éstos, el 0,5 % de los pacientes presentaban elevaciones de Grado 3 o 4. En pacientes que recibían hormonoterapia sola, el 91,0 % notificó un aumento en la creatinina sérica (todos los Grados de laboratorio). En los estudios MONARCH 2 y MONARCH 3, el 98,3 % de los pacientes presentaron elevaciones de la creatinina sérica (basado en hallazgos de laboratorio), y de éstos, el 1,9 % de los pacientes presentaron elevaciones de Grado 3 o 4. De los pacientes que recibieron un inhibidor de aromatasa o fulvestrant solo, el 78,4 % comunicó un aumento de la creatinina sérica (todos los Grados de laboratorio). Se ha demostrado que abemaciclib aumenta la creatinina sérica debido a la inhibición de transportadores de secreción tubular renal sin afectar a la función glomerular (medida por el aclaramiento de iohexol) (ver sección 4.5). En estudios clínicos, los aumentos de creatinina sérica ocurrieron dentro del primer mes de administración de abemaciclib, permanecieron elevados pero estables durante el período de tratamiento, fueron reversibles al suspender el tratamiento, y no se acompañaron de cambios en los marcadores de función renal, como nitrógeno ureico en sangre (blood urea nitrogen, BUN, por sus siglas en inglés), cistatina C, o tasa de filtración glomerular calculada según la cistatina C.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es.
 4.9 - Sobredosificación de VERZENIOS 50 mg Comp. recub. con película
4.9 - Sobredosificación de VERZENIOS 50 mg Comp. recub. con película
En caso de sobredosis con abemaciclib, se puede producir fatiga y diarrea. Se debe proporcionar tratamiento general de soporte.
 5. - PROPIEDADES FARMACOLÓGICAS
5. - PROPIEDADES FARMACOLÓGICAS
 5.1 - Propiedades farmacodinámicas de VERZENIOS 50 mg Comp. recub. con película
5.1 - Propiedades farmacodinámicas de VERZENIOS 50 mg Comp. recub. con película
Grupo farmacoterapéutico: agentes antineoplásicos, inhibidores de la proteína-quinasa, código ATC: L01EF03
Mecanismo de acción
Abemaciclib es un inhibidor potente y selectivo de las quinasas dependientes de ciclinas 4 y 6 (CDK4 y CDK6), y más activo frente a la Ciclina D1/CDK4 en ensayos enzimáticos. Abemaciclib previene la fosforilación de la proteína del retinoblastoma (Rb), bloqueando la progresión del ciclo celular desde la fase G1 a la fase S de la división celular, llevando a la supresión del crecimiento del tumor. En líneas celulares de cáncer de mama con receptor estrogénico positivo, la inhibición mantenida con abemaciclib previno el rebote de la fosforilación de Rb, dando como resultado senescencia celular y apoptosis. In vitro, las líneas celulares Rb-negativas y Rb-disminuidas son generalmente menos sensibles a abemaciclib. En modelos de xenoinjertos de cáncer de mama, la dosis diaria de abemaciclib sin interrupción a concentraciones clínicas relevantes, solo o en combinación con anti-estrógenos, dio como resultado la reducción del tamaño del tumor.
Efectos farmacodinámicos
En pacientes con cáncer, abemaciclib inhibe CDK4 y CDK6 como se ha indicado anteriormente, por inhibición de la fosfoliración del Rb y la topoisomerasa II alfa, lo que resultó en la inhibición del ciclo celular en la fase anterior al punto de restricción G1.
Electrofisiología cardiaca
Se evaluó el efecto de abemaciclib sobre el intervalo QTcF en 144 pacientes con cáncer avanzado. Siguiendo un esquema de dosis terapéuticas, no se detectaron variaciones importantes (que es, > 20 ms) en el intervalo QTcF durante la concentración máxima media observada en el estado estacionario.
En un análisis exposición-respuesta en individuos sanos a exposiciones comparables a la dosis de 200 mg dos veces al día, abemaciclib no prolongó en ningún grado clínicamente relevante el intervalo QTcF.
Eficacia clínica y seguridad
Cáncer de mama en estadios iniciales
Estudio Fase 3 aleatorizado monarchE: Verzenios en combinación con hormonoterapia
La eficacia y seguridad de Verzenios en combinación con hormonoterapia adyuvante se evaluó en el monarchE, un estudio fase 3 aleatorizado, abierto, de dos cohortes, en mujeres y hombres con cáncer de mama en estadios iniciales, positivo para HR y negativo para HER2, con afectación ganglionar o elevado riesgo de recidiva. El elevado riesgo de recidiva en la cohorte 1 se definió por las características clínicas y patológicas: ≥ 4 pALN (ganglios linfáticos axilares positivos, pALN, por sus siglas en inglés), o 1-3 pALN y al menos uno de los siguientes criterios: tamaño del tumor ≥ 5 cm o grado histológico 3.
Se aleatorizaron un total de 5637 pacientes en una proporción de 1:1 para recibir durante 2 años Verzenios 150 mg dos veces al día además de la elección del médico de la hormonoterapia estándar, o la hormonoterapia estándar sola. La aleatorización se estratificó por quimioterapia previa, estado menopáusico y región. Se estratificó a los hombres como postmenopáusicos. Los pacientes habían completado la terapia locorregional definitiva (con o sin quimioterapia neoadyuvante o adyuvante). Los pacientes debían haberse recuperado de los efectos secundarios agudos de cualquier quimioterapia o radioterapia anterior. Se requirió un período de lavado de 21 días después de la quimioterapia y 14 días después de la radioterapia antes de la aleatorización. Los pacientes podían recibir hasta 12 semanas de hormonoterapia adyuvante antes de la aleatorización. No se permitió el tratamiento adyuvante con fulvestrant como hormonoterapia estándar. Se eligió a los pacientes con estado funcional 0 o 1 de la escala eastern cooperative oncology group (ECOG). Los pacientes con antecedentes de TEVs se excluyeron del estudio. Una vez finalizado el periodo de tratamiento del estudio, en ambos grupos de tratamiento, los pacientes continuaron recibiendo hormonoterapia adyuvante durante una duración acumulada de al menos 5 años y hasta 10 años, si se consideraba clínicamente apropiado. A las mujeres pre y perimenopáusicas y a los hombres, se les administró agonistas de LHRH cuando estaba clínicamente indicado.
Entre los 5637 pacientes aleatorizados, 5120 se reclutaron en la cohorte 1, lo que representa el 91 % de la población ITT. En la cohorte 1, los datos demográficos de los pacientes y las características iniciales del tumor estaban equilibrados entre los grupos de tratamiento. La mediana de edad de los pacientes reclutados fue de aproximadamente 51 años (rango, 22-89 años), el 15 % de los pacientes tenían 65 años o más, el 99 % eran mujeres, el 71 % eran caucásicos, el 24 % eran asiáticos y el 5 % otros. El 43 % de las pacientes eran pre o perimenopáusicas. La mayoría de los pacientes recibieron quimioterapia previa (36 % neoadyuvante, 62 % adyuvante) y radioterapia previa (96 %). La hormonoterapia inicial que recibieron los pacientes incluyó letrozol (39 %), tamoxifeno (31 %), anastrozol (22 %) o exemestano (8 %).
En el momento de la cirugía, el 65 % de los pacientes tenía 4 o más ganglios linfáticos positivos, el 41 % tenía un tumor Grado 3 y el 24 % tenía un tamaño tumoral anatomopatológico de ≥ 5 cm.
La variable primaria en la población ITT fue la supervivencia libre de enfermedad invasiva (invasive disease-free survival, IDFS, por sus siglas en inglés) definida como: el tiempo desde la aleatorización hasta la primera aparición de la recidiva del tumor de mama invasivo ipsilateral, recidiva del cáncer de mama invasivo regional, recidiva a distancia, cáncer de mama invasivo contralateral, segundo cáncer primario invasivo distinto del de mama, o muerte atribuible a cualquier causa. La variable secundaria principal en la población ITT fue la supervivencia libre de recaída a distancia (distant relapse free survival, DRFS, por sus siglas en inglés) definida como el tiempo desde la aleatorización hasta la primera aparición de recidiva a distancia, o la muerte atribuible a cualquier causa.
En el análisis preliminar planificado (con fecha de corte 16 de marzo de 2020), se cumplió el objetivo principal del estudio. En la población ITT, se observó una mejora estadísticamente significativa en la IDFS en los pacientes que recibieron Verzenios además de hormonoterapia frente a hormonoterapia sola. La autorización se concedió para la amplia subpoblación de la cohorte 1.
En un análisis posterior (con fecha de corte 1 de abril de 2021), el 91 % de los pacientes de la cohorte 1 no alcanzaron los 2-años de tratamiento del estudio y la mediana de la duración del seguimiento fue de 27,7 meses.
Los resultados de eficacia en la cohorte 1 se resumen en la Tabla 9 y en la Figura 1.
Tabla 9. monarchE: resumen de los datos de eficacia (población de la cohorte 1)
| Verzenios con hormonoterapia N = 2555 | Hormonoterapia sola N = 2565 | |
| Supervivencia libre de enfermedad invasiva (IDFS, por sus siglas en inglés) | ||
| Número de pacientes con evento (n, %) | 218 (8,5) | 318 (12,4) |
| Hazard ratio (IC 95 %) | 0,680 (0,572; 0,808) | |
| IDFS a los 24 meses (%, IC 95 %) | 92,6 (91,4; 93,5) | 89,6 (88,3; 90,8) |
| Supervivencia libre de recaída a distancia (DRFS, por sus siglas en inglés) | ||
| Número de pacientes con evento (n, %) | 179 (7,0) | 266 (10,4) |
| Hazard ratio (IC 95 %) | 0,669 (0,554; 0,809) | |
| DRFS a los 24 meses (%, IC 95 %) | 94,1 (93,2; 95,0) | 91,2 (90,0; 92,3) |
Abreviatura: IC = intervalo de confianza.
Fecha de corte de los datos 1 de abril de 2021
Figura 1. monarchE: gráfico de Kaplan-Meier de IDFS (Evaluación del investigador, población de la cohorte 1)
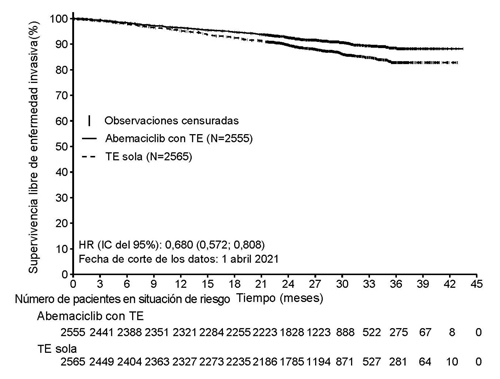
Abreviaturas: IC = intervalo de confianza; TE = hormonoterapia; HR = razón de riesgo; IDFS = supervivencia libre de enfermedad invasiva; N = número de pacientes en la población. Fecha de corte de los datos 1 de abril de 2021
Dentro de la cohorte 1 se observó beneficio en todos los pacientes de los subgrupos definidos por región geográfica, estado menopaúsico y quimioterapia previa.
Cáncer de mama avanzado o metastásico
Estudio Fase 3 aleatorizado MONARCH 3: Verzenios en combinación con un inhibidor de aromatasa
La eficacia y seguridad de Verzenios en combinación con un inhibidor de aromatasa (anastrozol o letrozol) se evaluó en el MONARCH 3, un estudio fase 3 aleatorizado, doble ciego, controlado con placebo, en mujeres con cáncer de mama localmente avanzado o metastásico positivo para HR, negativo para HER2 que no habían recibido tratamiento sistémico previo para esta etapa de la enfermedad. Las pacientes fueron aleatorizadas en una proporción 2:1 para recibir Verzenios 150 mg dos veces al día con un inhibidor de la aromatasa no esteroideo administrado diariamente a la dosis recomendada frente a placebo con un inhibidor de la aromatasa no esteroideo siguiendo la misma pauta. La variable primaria fue la supervivencia libre de progresión (progression-free survival, PFS, por sus siglas en inglés) evaluada por el investigador según RECIST 1.1; las variables secundarias principales de eficacia incluían la tasa de respuesta objetiva (overall response rate, ORR, por sus siglas en inglés), la tasa de beneficio clínico (clinical benefit rate, CBR, por sus siglas en inglés) y la supervivencia global (SG).
La mediana de edad de las pacientes incluidas fue de 63 años (intervalo 32 - 88 años).
Aproximadamente el 39 % de las pacientes había recibido quimioterapia y el 44 % había recibido tratamiento antihormonal en (neo) adyuvancia. Las pacientes con tratamiento antihormonal (neo) adyuvante previo, debían haber completado este tratamiento al menos 12 meses antes de la aleatorización del estudio. La mayoría de las pacientes (96 %) tenían enfermedad metastásica al inicio del estudio. Aproximadamente el 22 % de las pacientes solo tenía enfermedad ósea, y el 53 % de las pacientes tenía metástasis viscerales.
El estudio consiguió su variable primaria de mejorar la PFS. Los resultados de la eficacia principal se resumen en la Tabla 10 y en la Figura 2.
Tabla 10. MONARCH 3: resumen de los datos de eficacia (Evaluación del investigador, población con intención de tratar)
| Verzenios con inhibidor de aromatasa | Placebo con inhibidor de aromatasa | |
| Supervivencia libre de progresión | N = 328 | N = 165 |
| Evaluación del investigador, número de eventos (%) | 138 (42,1) | 108 (65,5) |
| Mediana [meses] (IC 95 %) | 28,18 (23,51; NR) | 14,76 (11,24; 19,20) |
| Hazard ratio (IC 95 %) y valor p | 0,540 (0,418; 0,698); p = 0,000002 | |
| Revisión radiográfica independiente, número de eventos (%) | 91 (27,7) | 73 (44,2) |
| Mediana [meses] (IC 95 %) | NR (NR; NR) | 19,36 (16,37; 27,91) |
| Hazard ratio (IC 95 %) y valor p | 0,465 (0,339; 0,636); p < 0,000001 | |
| Tasa de respuesta objetivab [%] (IC 95 %) | 49,7 (44,3 – 55,1) | 37,0 (29,6 – 44,3) |
| Duración de la respuesta [meses] (IC 95 %) | 27,39 (25,74; NR) | 17,46 (11,21; 22,19) |
| Respuesta objetiva para pacientes con enfermedad mediblea | N = 267 | N = 132 |
| Tasa de respuesta objetivab [%] (IC 95 %) | 61,0 (55,2 – 66,9) | 45,5 (37,0 – 53,9) |
| Respuesta completa, (%) | 3,4 | 0 |
| Respuesta parcial, (%) | 57,7 | 45,5 |
| Tasa de beneficio clínicoc (enfermedad medible) [%] (IC 95 %) | 79,0 (74,1; 83,9) | 69,7 (61,9; 77,5) |
a Enfermedad medible según RECIST versión 1.1
b Respuesta completa + respuesta parcial
c Respuesta completa + respuesta parcial + enfermedad estable para ≥ 6 meses
N = número de pacientes; IC = intervalo de confianza; NR = no alcanzada.
Figura 2. MONARCH 3: gráfico de Kaplan-Meier de supervivencia libre de progresión (Evaluación del investigador, población con intención de tratar)
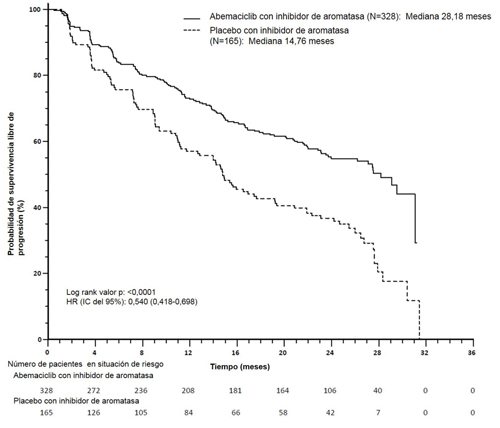
Estos resultados corresponden con una reducción clínicamente significativa en el riesgo de progresión de la enfermedad o muerte del 46 % de las pacientes tratadas con abemaciclib con un inhibidor de aromatasa.
Los datos de SG no eran maduros en el análisis final de la PFS (93 eventos observados entre los dos grupos). El HR fue 1,057 (IC 95 %: 0,683; 1,633), p = 0,8017.
Una serie de análisis de la PFS en subgrupos pre-especificados, mostró resultados consistentes en los subgrupos de pacientes incluyendo: edad (< 65 o ≥ 65 años), localización de la enfermedad, estadio de la enfermedad (metastásica de novo vs metastásica recurrente vs localmente avanzada recurrente), presencia de enfermedad medible, estado del receptor de progesterona, y estado funcional ECOG inicial. Se observó una reducción en el riesgo de progresión de la enfermedad o muerte en pacientes con enfermedad visceral (HR 0,567 [IC 95 %: 0,407; 0,789]), mediana de la PFS 21,6 meses frente a 14,0 meses; en pacientes con solo enfermedad ósea (HR de 0,565 [IC 95 %: 0,306; 1,044]); y en pacientes con enfermedad medible (HR de 0,517 [IC 95 %: 0,392; 0,681]).
En el primer análisis intermedio de la supervivencia global, se observaron 197 eventos entre los dos grupos y el HR fue 0,786 (IC 95 %: 0,589; 1,049).
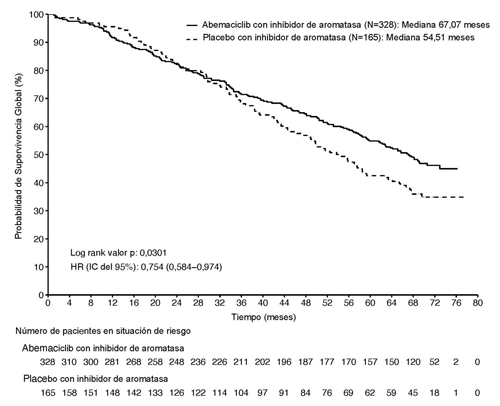
En el segundo análisis intermedio de la supervivencia global, se observaron 255 eventos entre los dos grupos. La mediana de la supervivencia global fue de 67,1 meses en el grupo de abemaciclib con IA y de 54,5 meses en el grupo de placebo con IA. Como el HR observado 0,754 (IC 95 %: 0,584; 0,974) no alcanzó significación estadística (Figura 3), el estudio continúa para caracterizar por completo la SG.
Figura 3. MONARCH 3: gráfico de Kaplan-Meier de supervivencia global (Población con intención de tratar)
Estudio Fase 3 aleatorizado MONARCH 2: Verzenios en combinación con fulvestrant
La eficacia y seguridad de Verzenios en combinación con fulvestrant se evaluó en el MONARCH 2, un estudio fase 3, aleatorizado, doble ciego, controlado con placebo en mujeres con cáncer de mama localmente avanzado o metastásico positivo para HR, negativo para HER2. Las pacientes fueron aleatorizadas en una proporción 2:1 para recibir Verzenios 150 mg dos veces al día con fulvestrant 500 mg a intervalos de un mes, con una dosis adicional de 500 mg administrada dos semanas después de la dosis inicial, frente a placebo con fulvestrant siguiendo la misma pauta. La variable primaria fue la PFS evaluada por el investigador según RECIST 1.1; las variables secundarias principales de eficacia incluían tasa de respuesta objetiva (ORR, por sus siglas en inglés), tasa de beneficio clínico (CBR, por sus siglas en inglés) y SG.
La mediana de edad de las pacientes incluidas fue de 60 años (intervalo de 32 - 91 años). En cada grupo de tratamiento la mayoría de las pacientes eran de raza blanca, y no habían recibido quimioterapia para la enfermedad metastásica. El 17 % de las pacientes eran pre/perimenopáusicas en situación de supresión ovárica con un agonista GnRH. Aproximadamente el 56 % de las pacientes tenía metástasis viscerales. Aproximadamente el 25 % de las pacientes tenía resistencia primaria endocrina (progresión en hormonoterapia en los primeros 2 años de hormonoterapia adyuvante o dentro de los primeros 6 meses de la primera línea de hormonoterapia para cáncer de mama metastásico), y la mayoría restante desarrolló resistencia endocrina posteriormente. El 59 % de las pacientes había recibido recientemente hormonoterapia en el contexto (neo) adyuvante, y el 38 % en la enfermedad metastásica.
El estudio alcanzó su variable primaria de mejorar la PFS. Los principales resultados de eficacia se resumen en la Tabla 11 y en la Figura 4.
Tabla 11. MONARCH 2: resumen de los datos de eficacia (Evaluación del investigador, población con intención de tratar)
| Verzenios con fulvestrant | Placebo con fulvestrant | |
| Supervivencia libre de progresión | N = 446 | N = 223 |
| Evaluación del investigador, número de eventos (%) | 222 (49,8) | 157 (70,4) |
| Mediana [meses] (IC 95 %) | 16,4 (14,4; 19,3) | 9,3 (7,4; 12,7) |
| Hazard ratio (IC 95 %) y valor p | 0,553 (0,449; 0,681); p = 0,0000001 | |
| Revisión radiográfica independiente, número de eventos (%) | 164 (36,8) | 124 (55,6) |
| Mediana [meses] (IC 95 %) | 22,4 (18,3; NR ) | 10,2 (5,8; 14,0) |
| Hazard ratio (IC 95 %) y valor p | 0,460 (0,363; 0,584); p < 0,000001 | |
| Tasa de respuesta objetivab [%] (IC 95 %) | 35,2 (30,8; 39,6) | 16,1 (11,3; 21,0) |
| Duración de la respuesta [meses] (IC 95 %) | NR (18,05; NR) | 25,6 (11,9; 25,6) |
| Respuesta objetiva para pacientes con enfermedad mediblea | N = 318 | N = 164 |
| Tasa de respuesta objetivab [%] (IC 95 %) | 48,1 (42,6; 53,6) | 21,3 (15,1; 27,6) |
| Respuesta completa, (%) | 3,5 | 0 |
| Respuesta parcial, (%) | 44,7 | 21,3 |
| Tasa de beneficio clínicoc (enfermedad medible) [%] (IC 95 %) | 73,3 (68,4; 78,1) | 51,8 (44,2; 59,5) |
a Enfermedad medible según RECIST versión 1.1
b Respuesta completa + respuesta parcial
c Respuesta completa + respuesta parcial + enfermedad estable para ≥ 6 meses
N = número de pacientes; IC = intervalo de confianza; NR = no alcanzada.
Figura 4. MONARCH 2: gráfico de Kaplan-Meier de supervivencia libre de progresión (evaluación del investigador, población con intención de tratar)
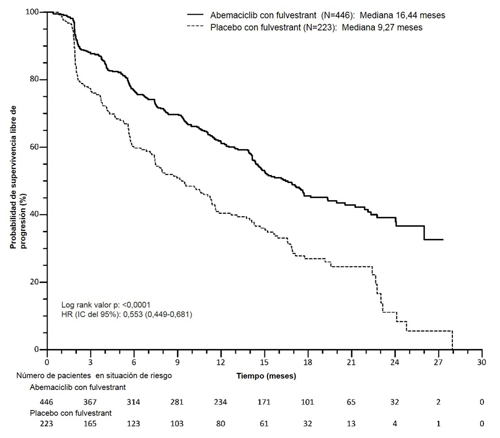
Estos resultados se corresponden con una reducción clínicamente significativa del riesgo de progresión de la enfermedad o muerte del 44,7 % en las pacientes tratadas con Verzenios con fulvestrant. Verzenios con fulvestrant prolongó la supervivencia libre de progresión sin perjuicio clínicamente significativo, ni deterioro importante de la calidad de vida relacionada con la salud.
Una serie de análisis de la PFS en subgrupos pre-especificados, mostró resultados consistentes a lo largo de los subgrupos de pacientes incluyendo: edad (< 65 o ≥ 65 años), raza, región geográfica, localización de la enfermedad, resistencia a la hormonoterapia, presencia de enfermedad medible, estado del receptor de progesterona y estado menopáusico. En las pacientes con enfermedad visceral se observó una reducción en el riesgo de progresión de la enfermedad o muerte (HR 0,481 [IC 95 %: 0,369; 0,627]), mediana de la PFS de 14,7 meses frente a 6,5 meses); en pacientes con solo enfermedad ósea (HR 0,543 [IC 95 %: 0,355; 0,833]); en pacientes con enfermedad medible (HR 0,523 [IC 95 %: 0,412; 0,644]). En el caso de las pacientes pre/perimenopáusicas, el hazard ratio fue 0,415 (IC 95 %: 0,246; 0,698); en las pacientes que tenían receptor de progesterona negativo, el HR fue 0,509 (IC 95 %: 0,325; 0,797).
En una subpoblación con enfermedad localmente avanzada o metastásica que no había recibido hormonoterapia previa, la PFS fue también consistente.
En el análisis intermedio pre-especificado de SG (con fecha de corte 20 de junio de 2019), la población ITT mostró una mejora estadísticamente significativa en los pacientes que recibieron Verzenios con fulvestrant en comparación con los que recibieron placebo con fulvestrant. Los resultados de SG se resumen en la Tabla 12.
Tabla 12. MONARCH 2: resumen de los datos supervivencia global (Población con intención de tratar)
| Verzenios con fulvestrant | Placebo con fulvestrant | |
| Supervivencia global | N = 446 | N = 223 |
| Número de eventos (n, %) | 211 (47,3) | 127 (57,0) |
| Mediana SG [meses] (IC 95 %) | 46,7 (39,2; 52,2) | 37,3 (34,4; 43,2) |
| Hazard ratio (IC 95 %) | 0,757 (0,606; 0,945) | |
| p-valor | 0,0137 | |
N = número de pacientes; IC = intervalo de confianza; SG = supervivencia global
El análisis de SG por factores de estratificación mostró un HR de 0,675 (IC 95 %: 0,511; 0,891) en pacientes con enfermedad visceral, y 0,686 (IC 95 %: 0,451; 1,043) en pacientes con resistencia endocrina primaria.
En el análisis final pre-especificado de SG (con fecha de corte 18 de marzo de 2022), se observaron 440 eventos en los 2 grupos. La mejoría en la SG observada previamente en el análisis intermedio de SG (con fecha de corte 20 de junio de 2019) se mantuvo en el grupo de abemaciclib más fulvestrant en comparación con el grupo de placebo más fulvestrant, con un HR de 0,784 (IC 95%: 0,644; 0,955). La mediana de SG fue de 45,8 meses en el grupo de abemaciclib más fulvestrant y de 37,25 meses en el grupo de placebo más fulvestrant. Los resultados de SG se muestran en la Figura 5.
Figura 5. MONARCH 2: gráfico de Kaplan-Meier de supervivencia global (Población con intención de tratar)
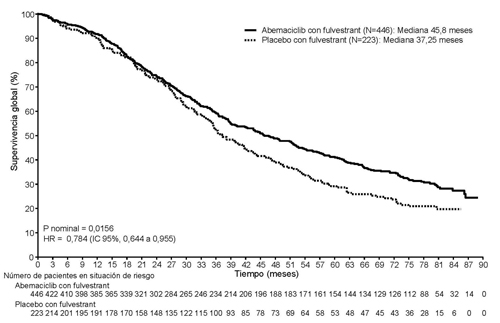
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Verzenios en todos los grupos de la población pediátrica en cáncer de mama (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
 5.2 - Propiedades farmacocinéticas de VERZENIOS 50 mg Comp. recub. con película
5.2 - Propiedades farmacocinéticas de VERZENIOS 50 mg Comp. recub. con película
Absorción
La absorción de abemaciclib es lenta, con un Tmax de 8 horas y una biodisponibilidad absoluta media de aproximadamente 45 %. En el rango de dosis terapéutica de 50 - 200 mg, el aumento en la exposición en plasma (AUC) y Cmax es aproximadamente proporcional a la dosis. Se alcanzó el estado estacionario dentro de los 5 días tras la administración repetida dos veces al día, y abemaciclib se acumuló con una media geométrica de proporción de acumulación de 3,7 (58 % CV) y 5,8 (65 % CV) basado en la Cmax y el AUC, respectivamente. Una comida rica en grasas aumentó el AUC combinado de abemaciclib y sus metabolitos activos en un 9 % y aumentó la Cmax en un 26 %. Estos cambios no se consideraron clínicamente relevantes. Por tanto, abemaciclib se puede tomar con o sin alimentos.
Distribución
Abemaciclib se une fuertemente a proteínas plasmáticas en humanos (la media de la fracción unida es aproximadamente del 96 % al 98 %). La media geométrica del volumen sistémico de distribución es 750 L (69 % CV) aproximadamente, indicando que abemaciclib se distribuye en los tejidos.
Las concentraciones de abemaciclib y sus metabolitos activos en el líquido cefalorraquídeo son comparables a las concentraciones libres en plasma.
Biotransformación
El metabolismo hepático es la vía principal de aclaramiento de abemaciclib. Abemaciclib se metaboliza a varios metabolitos principalmente por el citocromo P450 (CYP) 3A4. La biotransformación principal es la hidroxilación a un metabolito que circula con un AUC equivalente al 77 % del fármaco original. Además, los metabolitos N-desetil y N-desetilhidroxilo circulan con AUCs del 39 % y del 15 % del fármaco original. Estos metabolitos circulantes son activos con potencia similar a abemaciclib.
Eliminación
La media geométrica de aclaramiento hepático (CL) de abemaciclib fue de 21,8 l/h (39,8 % CV), y la media de la semivida de eliminación plasmática de abemaciclib en pacientes fue de 24,8 horas (52,1 % CV). Después de una única dosis por vía oral de [14C]abemaciclib, aproximadamente el 81 % de la dosis se excretó en heces y el 3,4 % se excretó en orina. La mayoría de la dosis eliminada en heces eran metabolitos.
Poblaciones especiales
Edad, sexo y peso corporal
En un análisis de farmacocinética poblacional en pacientes con cáncer, la edad, el sexo y el peso corporal no tuvieron ningún efecto en la exposición a abemaciclib (135 hombres y 859 mujeres; rango de edad 24 - 91 años; y rango de peso corporal 36 - 175 kg).
Insuficiencia hepática
Abemaciclib se metaboliza en el hígado. La exposición a abemaciclib no se vio afectada en la insuficiencia hepática leve (clase Child Pugh A) y moderada (clase Child Pugh B). En pacientes con insuficiencia hepática grave (clase Child Pugh C), el AUC0-∞ de abemaciclib y la potencia ajustada libre de abemaciclib más sus metabolitos activos, aumentó 2,1 veces y 2,4 veces, respectivamente. La vida media de abemaciclib aumentó de 24 a 55 horas (ver sección 4.2).
Insuficiencia renal
El aclaramiento renal de abemaciclib y sus metabolitos es menor. La exposición a abemaciclib no se vio afectada por la insuficiencia renal leve y moderada. No hay datos en pacientes con insuficiencia renal grave, enfermedad renal en etapa terminal ni en pacientes en diálisis.
 5.3 - Datos preclínicos sobre seguridad de VERZENIOS 50 mg Comp. recub. con película
5.3 - Datos preclínicos sobre seguridad de VERZENIOS 50 mg Comp. recub. con película
En estudios de ratones, ratas y perros de hasta 13 semanas de duración, los hallazgos principales sobre órganos diana de potencial relevancia para los humanos, ocurrieron en el tracto gastrointestinal, órganos linfohematopoyéticos y aparato reproductor en los machos. Los efectos en los ojos y las válvulas cardiacas ocurrieron solo en roedores con niveles de exposición clínicamente relevantes. Los efectos en pulmón y músculo esquelético ocurrieron solo en roedores con niveles de exposición al menos 2 veces mayores que los niveles de exposición humana. Los efectos en riñón ocurrieron solo en roedores con niveles de exposición al menos 6 veces mayores que los niveles de exposición humana. Al final del período de 28 días de recuperación, se observó una recuperación completa o parcial de todos los hallazgos en los órganos diana, con la excepción de los efectos en el aparato reproductor en los machos.
Genotoxicidad
En un ensayo de mutación bacteriana inversa (Ames) abemaciclib no fue mutagénico; en un ensayo in vitro de aberración cromosómica en linfocitos de sangre periférica humana no fue clastogénico y en un ensayo in vivo de micronúcleos de médula ósea de rata no fue clastogénico.
Carcinogenicidad
Se evaluó la carcinogenicidad de abemaciclib en estudios de 2 años en ratas y ratones. En ratas macho, la administración oral diaria de abemaciclib dio como resultado adenomas benignos de células intersticiales testiculares a exposiciones de aproximadamente 1,5 veces la exposición clínica humana. Además, se observó hiperplasia de células intersticiales a exposiciones de aproximadamente 0,1 veces la exposición clínica humana. Se desconoce si estos efectos se trasladarán a los humanos. No hubo hallazgos neoplásicos en ratones ni en ratas hembra asociados a la administración de abemaciclib.
Deterioro de la fertilidad
Abemaciclib puede afectar la fertilidad en los machos con potencial reproductivo. En estudios de toxicidad con dosis repetidas de hasta 3 meses de duración, los hallazgos relacionados con abemaciclib en los testículos, epidídimo, próstata y vesícula seminal incluyeron una disminución del peso de los órganos, restos celulares intratubulares, hipospermia, dilatación tubular, atrofia y degeneración/necrosis. Estos efectos ocurrieron en ratas y perros con exposiciones de aproximadamente 2 y 0,02 veces la exposición clínica humana, respectivamente. En un estudio de fertilidad en ratas macho, abemaciclib no tuvo efectos sobre el rendimiento reproductivo.
En un estudio de fertilidad y desarrollo embrionario temprano en ratas hembra y en estudios de toxicidad a dosis repetidas, abemaciclib no tuvo ningún efecto sobre el rendimiento reproductivo ni ningún efecto importante en el aparato reproductor en hembras que indique un riesgo de alteración de la fertilidad en hembras.
Toxicidad para el desarrollo
Abemaciclib fue teratogénico y causó una disminución del peso fetal en gestantes expuestas a dosis similares a la dosis humana recomendada.
 6. - DATOS FARMACÉUTICOS
6. - DATOS FARMACÉUTICOS
 6.1 - Lista de excipientes de VERZENIOS 50 mg Comp. recub. con película
6.1 - Lista de excipientes de VERZENIOS 50 mg Comp. recub. con película
Núcleo del comprimido
Croscarmelosa sódica
Lactosa monohidrato
Celulosa microcristalina
Sílice coloidal hidratada
Estearil fumarato de sodio
Recubrimiento con película
Verzenios 50 mg comprimidos recubiertos con película
Alcohol polivinílico (E1203)
Dióxido de titanio (E171)
Macrogol (E1521)
Talco (E553b)
Óxido de hierro amarillo (E172)
Óxido de hierro rojo (E172)
Verzenios 100 mg comprimidos recubiertos con película
Alcohol polivinílico (E1203)
Dióxido de titanio (E171)
Macrogol (E1521)
Talco (E553b)
Verzenios 150 mg comprimidos recubiertos con película
Alcohol polivinílico (E1203)
Dióxido de titanio (E171)
Macrogol (E1521)
Talco (E553b)
Óxido de hierro amarillo (E172)
 6.2 - Incompatibilidades de VERZENIOS 50 mg Comp. recub. con película
6.2 - Incompatibilidades de VERZENIOS 50 mg Comp. recub. con película
No procede.
 6.3 - Período de validez de VERZENIOS 50 mg Comp. recub. con película
6.3 - Período de validez de VERZENIOS 50 mg Comp. recub. con película
3 años.
 6.4 - Precauciones especiales de conservación de VERZENIOS 50 mg Comp. recub. con película
6.4 - Precauciones especiales de conservación de VERZENIOS 50 mg Comp. recub. con película
Este medicamento no requiere condiciones especiales de conservación.
 6.5 - Naturaleza y contenido del recipiente de VERZENIOS 50 mg Comp. recub. con película
6.5 - Naturaleza y contenido del recipiente de VERZENIOS 50 mg Comp. recub. con película
Blísteres de PCTFE/PE/PVC sellados con una lámina de aluminio en envases de 14, 28, 42, 56, 70 o 168 comprimidos recubiertos con película.
Blísteres precortados unidosis de aluminio/aluminio de 28 x 1 comprimidos recubiertos con película.
Puede que solamente estén comercializados algunos tamaños de envases.
 6.6 - Precauciones especiales de eliminación y otras manipulaciones de VERZENIOS 50 mg Comp. recub. con película
6.6 - Precauciones especiales de eliminación y otras manipulaciones de VERZENIOS 50 mg Comp. recub. con película
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
 7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Eli Lilly Nederland B.V., Papendorpseweg 83, 3528BJ Utrecht, Países Bajos.
 8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/18/1307/011
EU/1/18/1307/013
EU/1/18/1307/015
 9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 27/septiembre/2018
Fecha de la última renovación:
 10. - FECHA DE LA REVISIÓN DEL TEXTO
10. - FECHA DE LA REVISIÓN DEL TEXTO
23/Junio/2023
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu, y en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/.
Presentaciones y condiciones de prescripción y financiación
Verzenios 50 mg, 56 comprimidos recubiertos con película. (C.N: 723836.2): P.V.L.: 3.580 €; P.V.P.: 3.635,91 €; P.V.P. IVA: 3.781,35 €.
Verzenios 100 mg, 56 comprimidos recubiertos con película. (C.N: 723823.2): P.V.L.: 3.580 €; P.V.P.: 3.635,91 €; P.V.P. IVA: 3.781,35 €.
Verzenios 150 mg, 56 comprimidos recubiertos con película. (C.N: 723770.9): P.V.L.: 3.580 €; P.V.P.: 3.635,91 €; P.V.P. IVA: 3.781,35 €.
Medicamento sujeto a prescripción médica. Diagnóstico hospitalario.





