NERLYNX 40 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
| ATC: Neratinib |
| PA: Neratinib maleato |
Envases
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
3. - FORMA FARMACÉUTICA
4. - DATOS CLÍNICOS
5. - PROPIEDADES FARMACOLÓGICAS
6. - DATOS FARMACÉUTICOS
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
10. - FECHA DE LA REVISIÓN DEL TEXTO
 1. - NOMBRE DEL MEDICAMENTO
1. - NOMBRE DEL MEDICAMENTO
NERLYNX 40 mg Comp. recub. con película
 2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene neratinib maleato, equivalente a 40 mg de neratinib.
Para consultar la lista completa de excipientes, ver sección 6.1.
 3. - FORMA FARMACÉUTICA
3. - FORMA FARMACÉUTICA
Comprimido recubierto con película.
Comprimido recubierto con película ovalado, rojo, con «W104» grabado en una cara. Las dimensiones del comprimido son 10,5 mm x 4,3 mm, con un grosor de 3,1 mm.
 4. - DATOS CLÍNICOS
4. - DATOS CLÍNICOS
 4.1 - Indicaciones Terapéuticas de NERLYNX 40 mg Comp. recub. con película
4.1 - Indicaciones Terapéuticas de NERLYNX 40 mg Comp. recub. con película
Nerlynx está indicado en adultos para el tratamiento adyuvante extendido de cáncer de mama en estadio inicial con receptor hormonal positivo y sobreexpresión/amplificación de HER2, que hayan finalizado el tratamiento adyuvante a base de trastuzumab hace menos de un año.
 4.2 - Posología y administración de NERLYNX 40 mg Comp. recub. con película
4.2 - Posología y administración de NERLYNX 40 mg Comp. recub. con película
 4.3 - Contraindicaciones de NERLYNX 40 mg Comp. recub. con película
4.3 - Contraindicaciones de NERLYNX 40 mg Comp. recub. con película
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
Administración conjunta de los siguientes medicamentos que son inductores potentes de la isoforma CYP3A4 del citocromo P450 o de la glucoproteína P (gp-P), como (ver sección 4.5 y sección 5.2):
- Carbamazepina, fenitoína (antiepilépticos).
- Hipérico (Hypericum perforatum) (medicamento a base de plantas).
- Rifampicina (antimicobacteriano).
Insuficiencia hepática grave (clase C de Child-Pugh) (ver sección 5.2).
 4.4 - Advertencias y Precauciones de NERLYNX 40 mg Comp. recub. con película
4.4 - Advertencias y Precauciones de NERLYNX 40 mg Comp. recub. con película
Diarrea
Se ha notificado diarrea durante el tratamiento con Nerlynx (ver las secciones 4.2 y 4.8). La diarrea puede ser intensa y asociarse a deshidratación.
La diarrea, en general, suele aparecer al principio durante la primera o la segunda semana de tratamiento con Nerlynx, y puede ser recurrente.
Se debe indicar a los pacientes que empiecen un tratamiento profiláctico con un antidiarreico junto con la primera dosis de Nerlynx y que sigan tomando el antidiarreico con regularidad durante los primeros 1-2 meses de tratamiento con Nerlynx, ajustando la dosis hasta lograr 1-2 deposiciones al día.
Pacientes de edad avanzada
Los pacientes de edad avanzada (≥ 65 años) tienen un mayor riesgo de insuficiencia renal y deshidratación, que puede ser una complicación de la diarrea, por lo que se deben controlar de forma minuciosa.
Pacientes con trastornos gastrointestinales crónicos importantes
En el estudio pivotal no se incluyeron pacientes con trastornos gastrointestinales crónicos importantes cuyo síntoma principal fuera la diarrea, por lo que se debe vigilar estrechamente a este tipo de pacientes.
Insuficiencia renal
Los pacientes con insuficiencia renal tienen un mayor riesgo de complicaciones por deshidratación si presentan diarrea, por lo que se les debe vigilar estrechamente (ver sección 4.2 y sección 5.2).
Función hepática
Se ha notificado hepatotoxicidad en pacientes tratados con Nerlynx. Se deben realizar pruebas de función hepática que incluyan la determinación de alanina aminotransferasa (ALT), aspartato aminotransferasa (AST) y bilirrubina total en la semana 1, después de manera mensual durante los 3 primeros meses y, a partir de entonces, cada 6 semanas durante el tratamiento o cuando esté clínicamente indicado (ver sección 4.2).
Se evaluará a los pacientes que presenten diarrea de grado ≥ 3 con necesidad de fluidoterapia IV o cualquier signo o síntoma de hepatotoxicidad, como aumento del cansancio, náuseas, vómitos, ictericia, dolor o sensibilidad en el cuadrante superior derecho, fiebre, urticaria o eosinofilia, para detectar posibles cambios en las pruebas de función hepática. Durante la evaluación de la hepatotoxicidad, también se deben determinar la bilirrubina fraccionada y el tiempo de protrombina.
Función del ventrículo izquierdo
La inhibición de HER2 se ha asociado a disfunción del ventrículo izquierdo. Nerlynx no se ha estudiado en pacientes con una fracción de eyección del ventrículo izquierdo (FEVI) por debajo del límite inferior normal o con antecedentes cardíacos importantes. En los pacientes con factores de riesgo cardíaco conocidos se debe vigilar la función cardíaca, lo que incluirá una evaluación de la FEVI, cuando esté clínicamente indicado.
Inhibidores de la bomba de protones, antagonistas de los receptores H2 y antiácidos
Los tratamientos que aumentan el pH gastrointestinal pueden disminuir la absorción de neratinib, disminuyendo así la exposición sistémica. No se recomienda la administración conjunta con inhibidores de la bomba de protones (IBP) (ver sección 4.5 y sección 5.2).
En el caso de antagonistas de los receptores H2 o antiácidos se deben adaptar las modalidades de administración (ver sección 4.2, sección 4.5 y sección 5.2)
Embarazo
El neratinib puede provocar daños fetales si se administra a mujeres embarazadas (ver sección 4.6).
Trastornos de la piel y del tejido subcutáneo
Nerlynx se ha asociado a trastornos de la piel y del tejido subcutáneo. Los pacientes con trastornos sintomáticos de la piel y del tejido subcutáneo se deben controlar estrechamente (ver sección 4.8).
Tratamiento concomitante con inhibidores de la CYP3A4 y la gp-P
No es recomendable el tratamiento concomitante con inhibidores potentes o moderados de la CYP3A4 y la gp-P debido al riesgo de que aumente la exposición al neratinib. Si no se puede evitar el inhibidor, se debe aplicar el ajuste de dosis de Nerlynx (ver sección 4.2, sección 4.5 y sección 5.2).
Se debe evitar el consumo de zumo de pomelo y granada durante el tratamiento con Nerlynx (ver sección 4.2 y sección 4.5).
Tratamiento concomitante con inductores moderados de la CYP3A4 y la gp-P
No es recomendable el tratamiento concomitante con inductores moderados de la CYP3A4 y la gp-P debido a que puede conllevar una pérdida de la eficacia de neratinib (ver Sección 4.5 y Sección 5.2).
Tratamiento concomitante con sustratos de gp-P
Los pacientes que reciben tratamiento concomitante con agentes terapéuticos con un estrecho margen terapéutico cuya absorción involucra transportadores gp-P en el tracto gastrointestinal se deben controlar estrechamente (ver sección 4.5 y sección 5.2).
 4.5 - Interacciones con otros medicamentos de NERLYNX 40 mg Comp. recub. con película
4.5 - Interacciones con otros medicamentos de NERLYNX 40 mg Comp. recub. con película
Efectos de otras sustancias sobre neratinib
Neratinib se metaboliza principalmente por CYP3A4 y es un sustrato de gp-P.
Inductores de la CYP3A4 /gp-P
El estudio clínico ha demostrado que el uso concomitante de inductores potentes de CYP3A4 / gp-P disminuyó significativamente la exposición a neratinib, por lo tanto, el uso concurrente de neratinib con inductores potentes de CYP3A4 / gp-P está contraindicado (p. ej., inductores potentes: fenitoína, carbamazepina, rifampicina o preparados a base de plantas que contengan hipérico / Hypericum perforatum). No se recomienda el uso concurrente de neratinib con CYP3A4 / gp-P moderado, ya que también puede conllevar a una pérdida de eficacia (p. ej., inductores moderados: bosentán, efavirenz, etravirina, fenobarbital, primidona, dexametasona) (ver sección 4.3 y sección 5.2).
Inhibidores de la CYP3A4/gp-P
El estudio clínico y las predicciones basadas en modelos han demostrado que el uso concomitante de inhibidores potentes o moderados de CYP3A4 / gp-P aumentó significativamente la exposición sistémica a neratinib, por lo tanto, no es recomendado el uso concomitante de neratinib con inhibidores potentes y moderados de la CYP3A4/gp-P (p. ej., inhibidores potentes: atazanavir, indinavir, nefazodona, nelfinavir, ritonavir, saquinavir, lopinavir,ketoconazol, itraconazol, claritromicina, troleandomicina, voriconazol y cobicistat; inhibidores moderados: ciprofloxacina, ciclosporina, diltiazem, fluconazol, eritromicina, fluvoxamina y verapamilo). Si el inhibidor no puede ser evitado, la dosis de Nerlynx se debe ajustar (ver sección 4.2, sección .4.4 y sección 5.2).
El pomelo y la granada o el zumo de pomelo/granada también pueden aumentar las concentraciones plasmáticas de neratinib, por lo que se debe evitar su consumo (ver sección 4.2 y sección 4.4).
Inhibidores de la bomba de protones, antagonistas de los receptores H2 y antiácidos
La solubilidad in vitro del neratinib es dependiente de pH. El tratamiento concomitante con sustancias que aumenten el pH gástrico puede disminuir la absorción de neratinib, disminuyendo así la exposición sistémica. No se recomienda la administración conjunta con inhibidores de la bomba de protones (IBP) (p. ej., omeprazol o lansoprazol) (ver sección 4.4 y sección 5.2)..
Nerlynx se debe tomar al menos 2 horas antes o 10 horas después de la ingesta del antagonista del receptor H2 (ver sección 4.2, sección 4.4 y sección 5.2).
La administración de Nerlynx y la de antiácidos se debe espaciar al menos 3 horas (ver sección 4.2, sección .4.4 y sección 5.2).
Antidiarreico loperamida
El estudio clínico ha demostrado que no hubo diferencias clínicamente significativas en la exposición de los sujetos a neratinib con o sin administración simultánea de loperamida (ver sección 5.2).
Efectos del neratinib sobre otras sustancias
Anticonceptivos hormonales
Actualmente se desconoce si Nerlynx disminuye la eficacia de los anticonceptivos hormonales sistémicos. Por consiguiente, las mujeres que utilicen anticonceptivos hormonales sistémicos deben añadir un método de barrera (ver sección 4.6).
Transportador de eflujo de glucoproteína P
Se ha demostrado en estudios in vitro que el neratinib es un inhibidor de los transportadores de eflujo de glucoproteína P (gp-P). Esto ha sido confirmado por un estudio clínico que utiliza digoxina como sustrato sonda, lo que conlleva a un incremento del 54% y el 32% en la Cmáx y el AUC, respectivamente. Esto podría ser clínicamente relevante para pacientes tratados de forma concomitante con agentes terapéuticos con un estrecho margen terapéutico cuya absorción involucra transportadores gp-P en el tracto gastrointestinal (p. ej., digoxina, colchicina, dabigatrán, fenitoína, estatinas, ciclosporina, everolimus, sirolimus, tacrolimus). Estos pacientes se deben controlar de forma cuidadosa (ver sección 4.4 y sección 5.2).
Transportador de eflujo de la proteína de resistencia del cáncer de mama
Neratinib puede inhibir la proteína de resistencia del cáncer de mama (BCRP, por sus siglas en inglés) a nivel intestinal, como parecen indicar los estudios in vitro. No se han realizad un estudio clínico con sustratos de la BCRP. Como la administración conjunta de neratinib con sustratos de BCRP puede conllevar un incremento de su exposición, los pacientes tratados con sustratos de la BCRP (p. ej., rosuvastatina, sulfasalazina e irinotecán) se deben controlar de forma cuidadosa (sección 5.2).
 4.6 - Embarazo y Lactancia de NERLYNX 40 mg Comp. recub. con película
4.6 - Embarazo y Lactancia de NERLYNX 40 mg Comp. recub. con película
Mujeres en edad fértil/anticoncepción en mujeres y hombres
A partir de los datos en animales, neratinib puede causar daños fetales si se administra a mujeres embarazadas. Las mujeres deben evitar quedarse embarazadas mientras tomen Nerlynx y hasta 1 mes después de finalizar el tratamiento. Por lo tanto, las mujeres en edad fértil deben utilizar métodos anticonceptivos efectivos mientras tomen Nerlynx y durante 1 mes tras suspender el tratamiento.
En la actualidad, se desconoce si el neratinib puede reducir la eficacia de los anticonceptivos hormonales sistémicos, por lo que las mujeres que utilicen este tipo de anticonceptivos añadirán un método de barrera.
Los varones deberán utilizar un método anticonceptivo barrera durante el tratamiento y durante 3 meses tras suspenderlo.
Embarazo
No hay datos relativos al uso de Nerlynx en mujeres embarazadas. Los estudios realizados en animales han mostrado mortalidad embriofetal y anomalías morfológicas fetales (ver sección 5.3). Se desconoce el riesgo potencial para el ser humano. No debe utilizarse Nerlynx durante el embarazo a no ser que la situación clínica de la mujer requiera tratamiento con neratinib.
Si se utiliza neratinib durante el embarazo o si la paciente se queda embarazada mientras toma Nerlynx, se debe informar a la paciente del posible riesgo para el feto.
Lactancia
Se desconoce si el neratinib se excreta en la leche materna. No se puede excluir el riesgo para el lactante. Se debe decidir si es necesario interrumpir la lactancia o interrumpir el tratamiento con Nerlynx tras considerar el beneficio de la lactancia para el niño y el beneficio del tratamiento para la madre.
Fertilidad
No se han realizado estudios de fertilidad en mujeres ni en varones. No se detectaron alteraciones significativas de los parámetros de fertilidad en ratas macho y hembra con dosis de hasta 12 mg/kg/día (ver sección 5.3).
 4.7 - Efectos sobre la capacidad de conducción de NERLYNX 40 mg Comp. recub. con película
4.7 - Efectos sobre la capacidad de conducción de NERLYNX 40 mg Comp. recub. con película
La influencia de Nerlynx sobre la capacidad para conducir y utilizar máquinas es pequeña o moderada. Se han notificado cansancio, mareos, deshidratación y síncope como reacciones adversas del neratinib. Se tendrá en cuenta el estado clínico del paciente al evaluar su capacidad para realizar tareas que requieran criterio y destrezas motoras o cognitivas.
 4.8 - Reacciones Adversas de NERLYNX 40 mg Comp. recub. con película
4.8 - Reacciones Adversas de NERLYNX 40 mg Comp. recub. con película
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes de cualquier grado fueron diarrea (93,6 %), náuseas (42,5 %), cansancio (27,3 %), vómitos (26,8 %), dolor abdominal (22,7 %), erupción (15,4 %), apetito disminuido (13,7 %), dolor en la zona superior del abdomen (13,2 %), estomatitis (11,2 %) y espasmos musculares (10,0 %).
Las reacciones adversas de grado 3-4 más frecuentes fueron diarrea (grado 3, 36,9 % y grado 4, 0,2 %) y vómitos (grado 3, 3,4 % y grado 4, 0,1 %).
Las reacciones adversas notificadas como graves fueron diarrea (1,9 %), vómitos (1,3 %), deshidratación (1,1 %), náuseas (0,5 %), alanina aminotransferasa elevada (0,4 %), aspartato aminotransferasa elevada (0,4 %), dolor abdominal (0,3 %), cansancio (0,3 %) y apetito disminuido (0,2 %).
Tabla de reacciones adversas
En la tabla siguiente se enumeran las reacciones adversas observadas con neratinib, según la evaluación de los datos agrupados de 1.710 pacientes.
Para la clasificación de la frecuencia se han utilizado la convención sobre frecuencia y la base de datos de la clasificación por órganos y sistemas de MedDRA:
Muy frecuentes (≥ 1/10)
Frecuentes (≥ 1/100 a < 1/10)
Poco frecuentes (≥ 1/1.000 a < 1/100)
Raras (≥ 1/10.000 a < 1/1.000)
Muy raras (< 1/10.000)
Frecuencia no conocida (no puede estimarse a partir de los datos disponibles)
Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden de gravedad decreciente.
Tabla 5: Reacciones adversas de Nerlynx en monoterapia observadas en estudios en el cáncer de mama
| Clasificación por órganos y sistemas de MedDRA | Frecuencia | Reacción adversa |
| Infecciones e infestaciones | Frecuentes | Infección del tracto urinario |
| Trastornos del metabolismo y de la nutrición | Muy frecuentes | Apetito disminuido |
| Frecuentes | Deshidratación | |
| Trastornos del sistema nervioso | Frecuentes | Síncope |
| Trastornos respiratorios, torácicos y mediastínicos | Frecuentes | Epistaxis |
| Trastornos gastrointestinales | Muy frecuentes | Diarrea, vómitos, náuseas, dolor abdominal, dolor abdominal alto y estomatitis1 |
| Frecuentes | Distensión abdominal, boca seca y dispepsia | |
| Trastornos hepatobiliares | Frecuentes | Alanina aminotransferasa y aspartato aminotransferasa elevadas |
| Poco frecuentes | Bilirrubina en sangre elevada | |
| Trastornos de la piel y del tejido subcutáneo | Muy frecuentes | Erupción2 |
| Frecuentes | Trastornos de las uñas3, fisuras de la piel y piel seca | |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Muy frecuentes | Espasmos musculares |
| Trastornos renales y urinarios | Frecuentes | Creatinina en sangre elevada |
| Poco frecuentes | Fallo renal | |
| Trastornos generales y alteraciones en el lugar de administración | Muy frecuentes | Fatiga |
| Exploraciones complementarias | Frecuentes | Peso disminuido |
1 Incluye estomatitis, estomatitis aftosa, úlceras bucales, ampollas en la mucosa oral e inflamación de la mucosa.
2 Incluye erupción, erupción eritematosa, erupción folicular, erupción generalizada, erupción pruriginosa y erupción pustular.
3 Incluye trastornos de las uñas, paroniquia, onicoclasia y cambio del color de las uñas.
Descripción de determinadas reacciones adversas
Diarrea
De los 1.660 pacientes tratados con Nerlynx en monoterapia que no recibieron profilaxis con loperamida, el 94,6 % experimentó al menos un episodio de diarrea. Se notificó diarrea de grado 3 en el 37,5 % de los pacientes tratados con Nerlynx. El 0,2 % de los pacientes experimentó diarrea de grado 4. La diarrea fue motivo de hospitalización en el 1,9 % de los pacientes tratados con Nerlynx.
En general, la diarrea apareció en el primer mes, de manera que el 83,6 % de los pacientes notificaron esta toxicidad en la primera semana, el 46,9 % en la segunda semana, el 40,2 % en la tercera semana y el 43,2 % en la cuarta semana (la mediana del tiempo hasta el primer episodio fue de 2 días).
La mediana de la duración de un episodio único de diarrea de cualquier grado fue de 2 días. La mediana de la duración acumulada de la diarrea de cualquier grado fue de 59 días y la mediana de la duración acumulada de la diarrea de grado 3 fue de 5 días.
La diarrea también fue la reacción adversa más frecuente que motivó la suspensión del tratamiento; el 14,4 % de los pacientes tratados con Nerlynx sin profilaxis con loperamida suspendieron el tratamiento por diarrea. Se tuvo que reducir la dosis en el 24,7 % de los pacientes tratados con Nerlynx.
Erupción
El 16,7 % de los pacientes tratados con Nerlynx en monoterapia presentaron erupción. La incidencia de la erupción de grado 1 y de grado 2 fue del 13,3 % y del 2,9 %, respectivamente; el 0,4 % de los pacientes tratados con Nerlynx presentaron erupción de grado 3.
Trastornos de las uñas
El 7,8 % de los pacientes tratados con Nerlynx en monoterapia presentaron trastornos de las uñas. La incidencia de trastornos de grado 1 y de grado 2 fue del 6,2 % y del 1,4 %, respectivamente. El 0,2 % de los pacientes tratados con Nerlynx experimentaron trastornos de las uñas de grado 3.
Tanto la erupción como los trastornos de las uñas motivaron la suspensión del tratamiento en el 0,6 % de los pacientes tratados con Nerlynx.
Toxicidad hepática
En el estudio pivotal de fase III ExteNET (3004), se notificaron reacciones adversas hepáticas con mayor frecuencia en el grupo de Nerlynx comparado con el grupo del placebo (12,4 % frente al 6,6 %), y consistieron, principalmente, en elevaciones de la alanina aminotransferasa (ALT) (8,5 % frente al 3,2 %), elevaciones de la aspartato aminotransferasa (AST) (7,4 % frente al 3,3 %) y elevaciones de la fosfatasa alcalina en sangre (2,1 % frente al 1,1 %). Se notificaron reacciones adversas de grado 3 en el 1,6 % de los pacientes tratados con Nerlynx y en el 0,5 % de los tratados con placebo, y reacciones adversas de grado 4 en el 0,2 % y el 0,1 %, respectivamente. Se notificaron elevaciones de la ALT de grado 3 en el 1,1 % de los pacientes tratados con Nerlynx y en el 0,2 % de los tratados con placebo, y ALT elevada de grado 4 en el 0,2 % y el 0,0 %, respectivamente. Se notificaron AST elevada de grado 3 en el 0,5 % de los pacientes tratados con Nerlynx y en el 0,3 % de los tratados con placebo, y elevaciones de la AST de grado 4 en el 0,2 % y el 0,0 %, respectivamente. No se produjeron elevaciones de la bilirrubina en sangre que constituyesen reacciones adversas de grado 3 o 4.
Otras poblaciones especiales
Pacientes de edad avanzada
En el estudio pivotal de fase III ExteNET (3004), la media de edad era de 52 años en el grupo de Nerlynx, 1.236 pacientes tenían menos de 65 años, 172 tenían 65 años o más y 25 tenían más de 75 años.
Se observó una mayor frecuencia de suspensiones del tratamiento por reacciones adversas en el grupo de edad de 65 años o más que en el de menos de 65 años; en el grupo de Nerlynx, los porcentajes respectivos fueron del 44,8 % y del 25,2 %.
La incidencia de reacciones adversas graves en el grupo de Nerlynx frente al grupo del placebo fue del 7,0 % frente al 5,7 % (< 65 años) y del 9,9 % frente al 8,1 % (≥ 65 años). Las reacciones adversas graves notificadas con mayor frecuencia en el grupo de edad de 65 años o más fueron vómitos (2,3 %), diarrea (1,7 %), deshidratación (1,2 %) y fallo renal (1,2 %).
Las reacciones adversas que aparecieron durante el tratamiento y que motivaron la hospitalización en el grupo de Nerlynx frente al grupo del placebo fueron del 6,3 % frente al 4,9 % en el grupo de menos de 65 años y del 8,7 % frente al 8,1 % en el grupo de 65 años o más.
Efecto de la raza
En el estudio pivotal de fase III ExteNET (3004), la frecuencia de acontecimientos adversos aparecidos con el tratamiento (AAAT) en la clasificación por órganos y sistemas (SOC, por sus siglas inglés) de trastornos de la piel y del tejido subcutáneo fue mayor en los pacientes tratados con Nerlynx de origen asiático que en los de raza blanca (56,4 % frente al 34,5 %), pero equiparable en los tratados con placebo (24,9 % frente al 22,8 %). Los datos de seguridad agrupados de 1.710 pacientes tratados con Nerlynx en monoterapia revelaron una mayor incidencia de toxicidad dermatológica en los pacientes asiáticos (57,1 %) que en los de raza blanca (34,6 %).
En el análisis de los datos de seguridad agrupados, la mayoría de los AAAT de la SOC de trastornos de la piel y del tejido subcutáneo fueron de grado 1 (43,3 %) y 2 (12,3 %) en los pacientes asiáticos; en los pacientes de raza blanca, la incidencia de acontecimientos de grado 1 y grado 2 fue del 25,6 % y del 7,8 %, respectivamente. La frecuencia de acontecimientos de grado 3 fue similar entre los pacientes asiáticos y los de raza blanca (1,6 % frente al 1,0 %). No hubo diferencias en la frecuencia de AAG en la SOC de trastornos de la piel entre los subgrupos de raza asiática y blanca. Los AAAT más frecuentes en la SOC de trastornos de la piel que se produjeron con mayor frecuencia en los pacientes asiáticos que en los de raza blanca fueron erupción (29,4 % frente al 13,5 %), síndrome de eritrodisestesia palmoplantar (9,9 % frente al 1,0 %) y dermatitis acneiforme (6,0 % frente al 1,0 %).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es
 4.9 - Sobredosificación de NERLYNX 40 mg Comp. recub. con película
4.9 - Sobredosificación de NERLYNX 40 mg Comp. recub. con película
No existe ningún antídoto específico y se desconoce el beneficio de la hemodiálisis en el tratamiento de la sobredosis de Nerlynx. En caso de sobredosis, se debe posponer la administración y adoptar medidas de apoyo generales.
En el contexto de los ensayos clínicos, las reacciones adversas asociadas con mayor frecuencia a la sobredosis fueron diarrea, con o sin náuseas, vómitos y deshidratación.
En un estudio de escalada de dosis en voluntarios sanos, se administraron dosis orales únicas de Nerlynx de hasta 800 mg. La frecuencia y gravedad de los trastornos gastrointestinales (diarrea, dolor abdominal, náuseas y vómitos) parecieron estar relacionadas con la dosis. En estudios clínicos, no se han administrado dosis únicas de Nerlynx superiores a 800 mg.
 5. - PROPIEDADES FARMACOLÓGICAS
5. - PROPIEDADES FARMACOLÓGICAS
 5.1 - Propiedades farmacodinámicas de NERLYNX 40 mg Comp. recub. con película
5.1 - Propiedades farmacodinámicas de NERLYNX 40 mg Comp. recub. con película
Grupo farmacoterapéutico: agentes antineoplásicos, inhibidores de la proteínaquinasa, código ATC: L01EH02
Mecanismo de acción
El neratinib es un inhibidor irreversible de la tirosina quinasa (TKI, por sus siglas en inglés) del homólogo del oncogén viral de la leucemia paneritroblástica (ERBB) que bloquea la transducción de la señal del factor de crecimiento mitógeno mediante una unión covalente de alta afinidad al sitio de unión del ATP de 3 receptores del factor de crecimiento epidérmico (EGFR, por sus en inglés): EGFR (codificado por ERBB1), HER2 (codificado por ERBB2) y HER4 (codificado por ERBB4) o sus heterodímeros activos con HER3 (codificado por ERBB3). El resultado es una inhibición mantenida de estas vías que favorecen el crecimiento en los cánceres de mama con amplificación o sobreexpresión de HER2 o con mutaciones de HER2. El neratinib se une al receptor HER2, reduce la autofosforilación de EGFR y HER2 y las vías de señalización posteriores de MAPK y AKT e inhibe con gran potencia la proliferación de las células tumorales in vitro. El neratinib inhibió estirpes celulares de carcinoma que expresaban EGFR y/o HER2 con una CI50 celular inferior a 100 nM.
Eficacia clínica y seguridad
En el estudio pivotal de fase III, multicéntrico, aleatorizado, doble ciego y controlado con placebo ExteNET (3004), 2.840 mujeres con cáncer de mama HER2-positivo en estadio inicial (confirmado mediante un análisis local) que habían completado el tratamiento adyuvante con trastuzumab fueron aleatorizadas en proporción 1:1 para recibir Nerlynx o un placebo a diario durante un año. La mediana de edad de la población por intención de tratar (IT) era de 52 años (el 59,9 % tenía ≥ 50 años y el 12,3 %, ≥ 65 años); el 81,0 % eran de raza blanca, el 2,6 % eran negras o afroamericanas, el 13,6 % eran asiáticas y el 2,9 %, de otras razas. Al inicio, el 57,7 % presentaba enfermedad con receptores hormonales positivos (definida como RE-positiva y/o RPg-positiva), el 27,2% no presentaba afectación ganglionar, el 41,5 % presentaba afectación de uno a tres ganglios y el 29,4 % presentaba afectación de cuatro o más ganglios. Aproximadamente, el 10 % de las pacientes tenían tumores en estadio I, alrededor del 40 % tenían tumores en estadio II y alrededor del 30 % tenían tumores en estadio III. La mediana del tiempo transcurrido entre el último tratamiento adyuvante con trastuzumab y la aleatorización fue de 4,5 meses.
La variable principal del estudio fue la supervivencia libre de enfermedad invasiva (SLEi). Las variables secundarias del estudio fueron la supervivencia libre de enfermedad (SLE), incluido el carcinoma ductal in situ (SLE-CDIS), el tiempo hasta la recidiva a distancia (TRD), la supervivencia libre de enfermedad a distancia (SLED), la incidencia acumulada de recidivas en el sistema nervioso central y la supervivencia global (SG).
El análisis principal del estudio, realizado 2 años después de la aleatorización, demostró que Nerlynx reducía de manera significativa el riesgo de recidiva de la enfermedad invasiva o de muerte en un 33 % (HR = 0,67, IC del 95 % de 0,49-0,91 y valor de p bilateral = 0,011) en la población de análisis por intención de tratar (IT).
Tabla 6: Resultados principales de eficacia a los 2 años: población de análisis por IT y con receptor hormonal positivo que hayan finalizado el tratamiento con trastuzumab menos de un año antes
| Variable | Tasas estimadas sin episodios a los 2 años1 (%) | Hazard Ratio (IC del 95 %)2 | Valor de p3 | |
| Población IT | ||||
| Nerlynx (n = 1 420) | Placebo (n = 1 420) | |||
| Supervivencia libre de enfermedad invasiva | 94,2 | 91,9 | 0,67 (0,49-0,91) | 0,011 |
| Supervivencia libre de enfermedad, incluido el carcinoma ductal in situ | 94,2 | 91,3 | 0,62 (0,46-0,84) | 0,002 |
| Supervivencia libre de enfermedad a distancia | 95,3 | 94,0 | 0,75 (0,53-1,06) | 0,110 |
| Tiempo hasta la recidiva a distancia | 95,5 | 94,2 | 0,74 (0,52-1,06) | 0,102 |
| Recidiva en el SNC | 0,92 | 1,16 | – | 0,586 |
| Población con receptor hormonal positivo que hayan finalizado el tratamiento con trastuzumab menos de un año antes | ||||
| Nerlynx (n = 671) | Placebo (n = 668) | Hazard Ratio (IC del 95 %)4 | Valor de p5 | |
| Supervivencia libre de enfermedad invasiva | 95,3 | 90,9 | 0,50 (0,31-0,78) | 0,003 |
| Supervivencia libre de enfermedad, incluido el carcinoma ductal in situ | 95,3 | 90,1 | 0,45 (0,28-0,71) | <0,001 |
| Supervivencia libre de enfermedad a distancia | 96,1 | 93,0 | 0,53 (0,31-0,88) | 0,015 |
| Tiempo hasta la recidiva a distancia | 96,3 | 93,3 | 0,53 (0,30-0,89) | 0,018 |
| Recidiva en el SNC | 0,34 | 1,01 | – | 0,189 |
SNC = sistema nervioso central.
1 Se indican las tasas sin acontecimientos de todas la variables, excepto la recidiva en el SNC, para la que se indica la incidencia acumulada.
2 Modelo de Cox de riesgos proporcionales estratificado
3 Prueba del orden logarítmico bilateral estratificada para todas las variables, excepto la recidiva en el SNC, para la que se utilizó el método de Gray.
4 Modelo de Cox de riesgos proporcionales no estratificado
5 Prueba del orden logarítmico bilateral no estratificada para todas las variables, excepto la recidiva en el SNC, para la que se utilizó el método de Gray.
Figura 1: Gráfica de Kaplan-Meier de la supervivencia libre de enfermedad invasiva: población con receptor hormonal positivo que haya finalizado el tratamiento con trastuzumab hace menos de un año
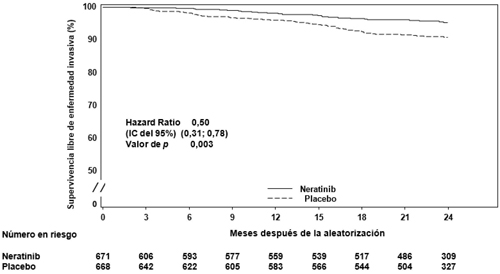
En la figura 2 se presenta el beneficio relativo del tratamiento con Nerlynx en pacientes con receptor hormonal positivo que estuvieron a menos de un año de la finalización del tratamiento con trastuzumab, dentro de los subgrupos de pacientes predefinidos.
Figura 2: Pacientes con receptor hormonal positivo que estuvieron a menos de un año de la finalización de la terapia con trastuzumab, supervivencia libre enfermedad invasiva por subgrupo de pacientes
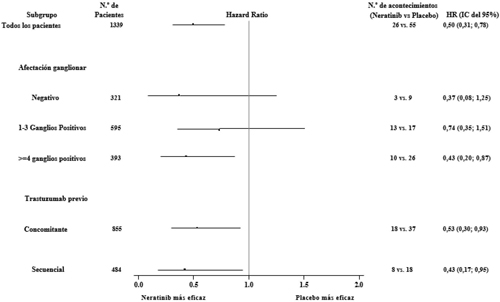
Nota: los pacientes (n = 30) que tenían una afectación ganglionar desconocida no se muestran porque no se pudo estimar la Hazard Ratio
En pacientes con receptor hormonal negativo, con independencia del tiempo transcurrido desde el tratamiento con trastuzumab, la Hazard Ratio para la SLEi a los 2 años fue de 0,94, con un IC del 95 % de 0,61-1,46. No se ha demostrado la eficacia en esta población.
Aproximadamente, el 75 % de las pacientes renovaron su consentimiento para ampliar el seguimiento después de los 24 meses. Las observaciones con datos omitidos se censuraron en la última fecha de evaluación. Aunque el beneficio del tratamiento con Nerlynx comparado con placebo se mantenía a los cinco años, no se puede estimar de forma fiable la magnitud del efecto.
La mediana del tiempo de seguimiento de la SG para la población IT fue de 8,06 años, 8,03 años en el grupo de neratinib y 8,10 años en el grupo de placebo, con un total de 1.542 (54,3%) pacientes seguidos para la supervivencia durante 8 años o más, 746 (52,5%) en el grupo de neratinib y 796 (56,1%) en el grupo de placebo. El número de muertes fue de 264 (9,3%), 127 (8,9%) en los pacientes tratados con neratinib y 137 (9,6%) en los pacientes tratados con placebo.
Con una mediana de seguimiento de 8,06 años, no hubo diferencias estadísticamente significativas en la supervivencia global entre el grupo de Nerlynx y el de placebo [HR 0,96 (IC del 95%: 0,75-1,22)] en la población IT.
En la población con receptor hormonal positivo que estaba a menos de un año de la finalización del tratamiento con trastuzumab, la mediana de seguimiento fue de 8,0 años en el grupo de neratinib y de 8,1 años en el grupo de placebo, con un total de 1.339 (47,1%) pacientes seguidos para la supervivencia durante 8 años o más, 671 (23,6%) en el grupo de neratinib y 668 (23,5%) en el grupo de placebo. En esta subpoblación, el número de muertes fue de 55 (8,2%) en los pacientes tratados con neratinib y 68 (10,2%) en los pacientes tratados con placebo [HR 0,83 (IC del 95%, 0,58-1,18)].
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados en todos los grupos de la población pediátrica en el tratamiento del carcinoma de mama.
 5.2 - Propiedades farmacocinéticas de NERLYNX 40 mg Comp. recub. con película
5.2 - Propiedades farmacocinéticas de NERLYNX 40 mg Comp. recub. con película
Se estudió el balance de masas tras la administración de una dosis oral única de 200 mg de neratinib en seis sujetos sanos.
Absorción
Tras la administración oral de 240 mg de neratinib, la absorción fue lenta y las concentraciones plasmáticas máximas de neratinib se alcanzaron alrededor de 7 horas después de la administración. Una dosis única de 240 mg de neratinib tomada con alimentos aumentó la Cmáx y el AUC alrededor de un 17 % y un 23 %, respectivamente, comparado con la administración en ayunas. Una dosis oral única de 240 mg de neratinib tomada con una comida rica en grasas aumentó tanto la Cmáx como el AUC un 100 %, aproximadamente. En un estudio de balance de masa, la recuperación total (excreción urinaria y fecal) de neratinib y metabolitos intactos demuestra que la fracción absorbida por neratinib es de al menos 10% y probablemente de más del 20%. Además, las predicciones basadas en modelos sugirieron una fracción global absorbida del intestino (fa) del 26%.
La solubilidad in vitro de neratinib es pH dependiente. Los tratamientos que aumentan el pH gastrointestinal pueden disminuir la absorción de neratinib, disminuyendo así la exposición sistémica.
Distribución
La unión de neratinib a las proteínas plasmáticas humanas, incluida la unión covalente a la albúmina sérica humana (ASH), fue superior al 98 % e independiente de la concentración de neratinib analizada. Neratinib se unió de forma principal a la ASH y a la alfa-1 glucoproteína ácida humana (AAG). La unión del metabolito principal M6 (M6) a las proteínas plasmáticas humanas fue superior al 99% e independiente de las concentraciones de M6 probadas.
Los estudios in vitro demostraron que neratinib es un sustrato de la glucoproteína P (gp-P) (Ver sección 4.2, sección 4.3, sección 4.4 y sección 4.5) y BCRP. Los estudios in vitro demostraron que neratinib y su metabolito principal M6 no son sustratos de los transportadores de absorción hepática OATP1B1 * 1a y OATP1B3 a 10 μM.
Biotransformación
Neratinib se metaboliza de forma principal en los microsomas hepáticos por la CYP3A4 y, en menor medida, por la flavomonooxigenasa (FMO).
El perfil preliminar de metabolitos en plasma humano indica que, tras la administración oral, neratinib experimenta metabolismo oxidativo a través de la CYP3A4. Los metabolitos circulantes son N-óxido de piridina de neratinib (M3), N-desmetil-neratinib (M6), N-óxido de dimetilamina de neratinib (M7) y trazas de N-óxido de hidroxil-neratinib y bis-N-óxido de neratinib (M11). Neratinib es el componente más importante en el plasma y entre los metabolitos circulantes ( M2, M3, M6, M7 y M11) ninguno es superior al 8% de la exposición total de neratinib más metabolito tras la suministración oral de neratinib. Se mostró que los metabolitos M3, M6, M7 y M11 del neratinib tenían potencias similares a la de neratinib en análisis enzimáticos in vitro (análisis de unión) o en análisis celulares frente a células que expresan ERBB1, ERBB2 (HER2) y ERBB4.
Basado en exposiciones en estado estacionario, neratinib proporciona la mayor parte de la actividad farmacológica (73%), con un 20% proporcionado por la exposición a M6, un 6% proporcionado por M3 y una contribución insignificante (<1%) de M7 y M11 AUC.
Eliminación
Tras la administración de dosis únicas de neratinib, la semivida plasmática aparente media del neratinib fue de 17 horas.
El neratinib se excreta de forma principal por vía fecal
Tras la administración de una dosis única radiomarcada de 240 mg de neratinib en solución oral, el 95,5 % de la dosis administrada se recuperó en heces y el 0,96 % en la orina, respectivamente.
La excreción fue rápida y completa, con la mayor parte de la dosis recuperada en las heces dentro de las 48 horas y el 96,5% de la radioactividad total recuperada en las heces al cabo de 8 días.
Neratinib inalterado fue la especie más abundante en las heces, representando el 62,1% de la dosis total recuperada en heces. Los metabolitos más abundantes en las heces fueron M6 (19,7% de la dosis administrada), seguidos de M2, M3 y M7, todos por debajo del 10% de la dosis administrada.
Interacciones medicamentosas
Efecto del inductor CYP3A4 / gp-P sobre neratinib
Después de la administración concomitante de 240 mg de neratinib con dosis repetidas de 600 mg de rifampicina, un inductor potente de CYP3A4 / gp-P, las exposiciones a neratinib disminuyeron significativamente en un 76% y 87% para la Cmáx y el AUC, respectivamente, en comparación con la administración de neratinib solo.
Efecto del inhibidor CYP3A4 / gp-P sobre neratinib
La administración conjunta de una dosis oral única de 240 mg de neratinib en presencia de ketoconazol (400 mg una vez al día durante 5 días), un fuerte inhibidor de CYP3A4 / gp-P, aumentó la exposición sistémica de neratinib en 3,2 y 4,8 veces para la Cmáx y AUC, respectivamente, en comparación con neratinib administrado solo.
Las predicciones basadas en modelos sugirieron que la administración conjunta de una dosis oral única de 240 mg de neratinib en presencia de fluconazol (200 mg una vez al día durante 8 días), un inhibidor moderado de CYP3A4, aumentó la exposición sistémica de neratinib en 1,3 y 1,7 veces para Cmax y AUC, en comparación con neratinib administrado solo.
Las predicciones basadas en modelos sugirieron que la administración conjunta de una dosis oral única de 240 mg de neratinib en presencia de verapamilo (120 mg dos veces al día durante 8 días), un inhibidor moderado de CYP3A4 / inhibidor fuerte de gp-P, aumentó la exposición sistémica de neratinib en 3,0 y 4,0 veces para Cmax y AUC, en comparación con neratinib administrado solo (ver sección 4.2, sección 4.4 y sección 4.5).
Efecto de los modificadores de pH gástricos sobre neratinib
La administración conjunta de lansoprazol o ranitidina (1x300 mg) con una dosis única de 240 mg de neratinib en voluntarios sanos resultó en una disminución de la exposición a neratinib en alrededor del 70% o 50%, respectivamente. La magnitud de la interacción de ranitidina con el AUC de neratinib se redujo en aproximadamente un 25%, al escalonar la administración de ranitidina (2x150 mg) 2 horas después de la administración de neratinib (ver Sección 4.2, Sección 4.4 y Sección 4.5).
Efecto de otro tratamiento sobre neratinib
No se observaron interacciones farmacológicas clínicamente relevantes aparentes para neratinib cuando se administró concomitantemente con capecitabina, paclitaxel, trastuzumab, vinorelbina o antidiarreicos (loperamida) (ver sección 4.5).
Efecto de neratinib sobre sustratos de CYP
Neratinib y el metabolito M6 no fueron inhibidores directos potentes de CYP1A2, 2A6, 2B6, 2C8, 2C9, 2D6 o 3A4. No se puede excluir la inhibición tiempo-dependiente de CYP3A4 y CYP2B6 por neratinib y M6.
Neratinib no indujo CYP1A2, 2B6, 2C9 o 3A4.
Efecto de neratinib en los transportadores
No hubo inhibición clínicamente relevante de la actividad in vitro del transportador de eflujo BSEP humano, notificándose un valor de CI50 > 10 μM. Neratinib a 10 μM pareció inhibir el transportador de eflujo BCRP que podría ser clínicamente relevante a nivel intestinal (ver sección 4.5).
En estudios in vitro, neratinib fue un inhibidor de los transportadores de eflujo de glicoproteína P (gp-P), lo que se confirmó en un estudio clínico. Múltiples dosis orales de neratinib 240 mg aumentan las exposiciones a digoxina (54 y 32% de aumento en la Cmáx y el AUC, respectivamente) sin impacto en su nivel de aclaramiento renal (ver sección 4.4 y sección 4.5).
Neratinib no produjo actividad inhibitoria hacia los transportadores de absorción, OATP1B1 * 1a, OATP1B3, OAT1, OAT3 y OCT2, notificándose un valor de CI50 > 10 μM. Neratinib produjo actividad inhibitoria en el transportador de captación OCT1, con una IC50 de 2,9 μM.
Poblaciones especiales
Insuficiencia renal
No se han realizado estudios farmacocinéticos en pacientes con insuficiencia renal o sometidos a diálisis. La aplicación de un modelo farmacocinético poblacional reveló que el aclaramiento de creatinina no explicaba la variabilidad entre los pacientes, por lo que no se recomienda modificar la dosis en los pacientes con insuficiencia renal leve o moderada (ver sección 4.2 y sección 4.4).
Insuficiencia hepática
Neratinib se metaboliza en gran parte en el hígado. En sujetos con insuficiencia hepática prexistente grave (clase C de Child Pugh) sin cáncer, el aclaramiento del neratinib disminuyó un 36 % y la exposición al neratinib aumentó unas 3 veces comparado con voluntarios sanos (ver sección 4.2 y sección 4.4).
 5.3 - Datos preclínicos sobre seguridad de NERLYNX 40 mg Comp. recub. con película
5.3 - Datos preclínicos sobre seguridad de NERLYNX 40 mg Comp. recub. con película
Las reacciones adversas no observadas en ensayos clínicos, pero detectadas en animales a niveles de exposición similares a la exposición clínica y con posible repercusión en el uso clínico fueron las siguientes:
Carcinogénesis, mutagénesis
Nerlynx no fue clastógeno ni mutágeno en la serie estándar de estudios de genotoxicidad.
Los metabolitos M3, M6, M7 y M11 del neratinib son negativos en la serie estándar de estudios de genotoxicidad in vitro.
Un estudio de carcinogenicidad de 6 meses de duración en ratones transgénicos Tg.rasH2 y los datos observados en ratas al cabo de 2 años no mostraron signos de potencial carcinogénico.
Toxicidad para la reproducción
En conejos, no se observaron efectos sobre el apareamiento ni sobre la capacidad de las hembras para quedar preñadas, aunque se observaron mortalidad embriofetal y anomalías morfológicas fetales (p. ej., abombamiento craneal, dilatación de los ventrículos cerebrales, deformidad de la fontanela anterior y aumento del tamaño de la fontanela anterior y/o posterior) con dosis que se podrían considerar de interés clínico.
Evaluación del riesgo medioambiental (ERA, por sus siglas en inglés)
Los estudios de evaluación del riesgo ambiental han mostrado que neratinib tiene un potencial evidente de ser persistente, bioacumulativo y tóxico para el medio ambiente (ver sección 6.6).
 6. - DATOS FARMACÉUTICOS
6. - DATOS FARMACÉUTICOS
 6.1 - Lista de excipientes de NERLYNX 40 mg Comp. recub. con película
6.1 - Lista de excipientes de NERLYNX 40 mg Comp. recub. con película
Núcleo del comprimido
Manitol (E421)
Celulosa microcristalina
Crospovidona
Povidona
Sílice coloidal anhidra
Estearato de magnesio
Recubrimiento del comprimido
Alcohol polivinílico
Dióxido de titanio (E171)
Macrogol
Talco
Rojo óxido de hierro (E172)
 6.2 - Incompatibilidades de NERLYNX 40 mg Comp. recub. con película
6.2 - Incompatibilidades de NERLYNX 40 mg Comp. recub. con película
No procede.
 6.3 - Período de validez de NERLYNX 40 mg Comp. recub. con película
6.3 - Período de validez de NERLYNX 40 mg Comp. recub. con película
3 años.
 6.4 - Precauciones especiales de conservación de NERLYNX 40 mg Comp. recub. con película
6.4 - Precauciones especiales de conservación de NERLYNX 40 mg Comp. recub. con película
Mantener el frasco perfectamente cerrado para protegerlo de la humedad.
Este medicamento no requiere ninguna temperatura especial de conservación.
 6.5 - Naturaleza y contenido del recipiente de NERLYNX 40 mg Comp. recub. con película
6.5 - Naturaleza y contenido del recipiente de NERLYNX 40 mg Comp. recub. con película
Frasco blanco de 60 ml, de polietileno de alta densidad (HDPE, por sus siglas en inglés) redondo, con cierre de seguridad a prueba de niños de polipropileno y sello interno de inducción de aluminio.
En cada frasco se incluye junto con los comprimidos una bolsa desecante de HDPE con 1 g de gel de sílice.
Cada frasco contiene 180 comprimidos.
 6.6 - Precauciones especiales de eliminación y otras manipulaciones de NERLYNX 40 mg Comp. recub. con película
6.6 - Precauciones especiales de eliminación y otras manipulaciones de NERLYNX 40 mg Comp. recub. con película
Este medicamento puede suponer un riesgo para el medio ambiente (ver sección 5.3).
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
 7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
PIERRE FABRE MEDICAMENT
Les Cauquillous
81500 Lavaur
Francia
 8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/18/1311/001
 9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 31/agosto/2018
 10. - FECHA DE LA REVISIÓN DEL TEXTO
10. - FECHA DE LA REVISIÓN DEL TEXTO
Abril 2022
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu.
11. PRESENTACIÓN Y PRECIO DE VENTA AL PÚBLICO: Frasco con 180 comprimidos: PVP: 5.095,91€ y PVP IVA: 5.299,75€. “Comprobar PVP”.
12. RÉGIMEN Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN: Con receta médica. Diagnóstico Hospitalario. Financiado por el Sistema Nacional de Salud. Solo está financiado para pacientes en determinadas condiciones.


