 TIBSOVO 250 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
TIBSOVO 250 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
| ATC: Ivosidenib |
| PA: Ivosidenib |
| EXC: Lactosa monohidrato y otros. |
Envases
 Introducción
Introducción
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
Tibsovo 250 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 250 mg de ivosidenib. Excipiente con efecto conocido
Cada comprimido recubierto con película contiene lactosa monohidrato equivalente a 9,5 mg de lactosa (ver sección 4.4).
Para consultar la lista completa de excipientes, ver sección 6.1
3. FORMA FARMACÉUTICA
Comprimido recubierto con película (comprimido).
Comprimido recubierto con película de color azul, ovalado, aproximadamente de 18 mm de longitud, y grabado con "IVO" en una cara y "250" en la otra.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
Tibsovo, en combinación con azacitidina, está indicado para el tratamiento de pacientes adultos con leucemia mieloide aguda (LMA) de nuevo diagnóstico con mutación de la isocitrato deshidrogenasa-1 (IDH1) R132, que no son candidatos a quimioterapia de inducción estándar (ver sección 5.1).
Tibsovo en monoterapia está indicado para el tratamiento de pacientes adultos con colangiocarcinoma localmente avanzado o metastásico con mutación IDH1 R132 que hayan recibido al menos una línea previa de tratamiento sistémico (ver sección 5.1).
4.2 Posología y forma de administración
El tratamiento debe ser iniciado bajo la supervisión de médicos con experiencia en el uso de medicamentos contra el cáncer.
Antes de tomar Tibsovo, los pacientes deben tener confirmación de una mutación IDH1 R132 mediante una prueba de diagnóstico adecuada.
Posología
Leucemia mieloide aguda
La dosis recomendada es de 500 mg de ivosidenib (2 comprimidos de 250 mg) por vía oral una vez al día.
Ivosidenib se debe iniciar el Día 1 del Ciclo 1, en combinación con azacitidina a 75 mg/m2 de área de
superficie corporal por vía intravenosa o subcutánea una vez al día los Días 1 a 7 de cada ciclo de 28
días. El primer ciclo de tratamiento con azacitidina se debe administrar al 100% de la dosis. Se recomienda que los pacientes sean tratados durante un mínimo de 6 ciclos.
Para la posología y método de administración de azacitidina, por favor consulte la Ficha Técnica completa de azacitidina.
El tratamiento se debe continuar hasta progresión de la enfermedad o hasta que el paciente deje de tolerar el tratamiento.
Colangiocarcinoma
La dosis recomendada es de 500 mg de ivosidenib (2 comprimidos de 250 mg) por vía oral una vez al día.
El tratamiento se debe continuar hasta progresión de la enfermedad o hasta que el paciente deje de tolerar el tratamiento.
Dosis olvidadas o retrasadas
Si se olvida una dosis o no se toma a la hora habitual, los comprimidos deben tomarse lo antes posible dentro de las 12 horas siguientes a la dosis olvidada. No deben tomarse dos dosis en un plazo de
12 horas. Los comprimidos deben tomarse como habitualmente al día siguiente.
Si se vomita una dosis, no se deben tomar comprimidos de reemplazo. Los comprimidos deben tomarse como habitualmente al día siguiente.
Precauciones que deben tomarse antes de la administración y la monitorización
Antes de iniciar el tratamiento se debe realizar un electrocardiograma (ECG). El intervalo QT
corregido para la frecuencia cardíaca (QTc) debe ser inferior a 450 ms antes de iniciar el tratamiento y, en presencia de un QT anormal, los médicos deben reevaluar exhaustivamente el beneficio/riesgo de iniciar el tratamiento con ivosidenib. En caso de que la prolongación del intervalo QTc se sitúe
entre 480 ms y 500 ms, el inicio del tratamiento con ivosidenib debe ser excepcional e ir acompañado de una estrecha monitorización.
Se debe realizar un ECG antes del inicio del tratamiento, al menos una vez a la semana durante las primeras 3 semanas de tratamiento y posteriormente una vez al mes si el intervalo QTc permanece
≤ 480 ms. Las anomalías del intervalo QTc se deben tratar inmediatamente (ver Tabla 1 y sección 4.4). En caso de sintomatología sugestiva, se debe realizar un ECG según indicación clínica.
La administración concomitante de medicamentos que prolongan el intervalo QTc, o de inhibidores moderados o potentes del CYP3A4 puede aumentar el riesgo de prolongación del intervalo QTc y se debe evitar siempre que sea posible durante el tratamiento con Tibsovo. Si no es posible el uso de una alternativa adecuada, los pacientes deben ser tratados con precaución y monitorizados estrechamente por la prolongación del intervalo QTc. Se debe realizar un ECG antes de la coadministración, realizar un seguimiento semanal durante al menos 3 semanas y después según se indique clínicamente (ver más abajo y las secciones 4.4, 4.5 y 4.8).
Antes de iniciar el tratamiento con Tibsovo se deben evaluar el recuento hematológico completo y el análisis bioquímico de la sangre, al menos una vez a la semana durante el primer mes de tratamiento, una vez cada dos semanas durante el segundo mes, y en cada visita médica durante la duración del tratamiento según se indique clínicamente.
Modificación de la dosis en caso de administración concomitante de inhibidores moderados o potentes del CYP3A4
Si no se puede evitar el uso de inhibidores moderados o potentes del CYP3A4, la dosis recomendada de ivosidenib se debe reducir a 250 mg (1 comprimido de 250 mg) una vez al día. Si se interrumpe el uso del inhibidor moderado o potente del CYP3A4, la dosis de ivosidenib se debe aumentar a 500 mg después de, al menos, 5 semividas del inhibidor del CYP3A4 (ver arriba y secciones 4.4 y 4.5).
Modificaciones de la dosis y recomendaciones de gestión de las reacciones adversas
Tabla 1 - Modificaciones de dosis recomendadas para las reacciones adversas
| Reacción adversa | Medidas recomendadas |
| Síndrome de diferenciación (ver secciones 4.4 y 4.8) | Si se sospecha un síndrome de diferenciación, administrar corticosteroides sistémicos durante un mínimo de 3 días y reducir gradualmente sólo después de la resolución de los síntomas. La interrupción prematura puede provocar la reaparición de los síntomas. Iniciar la monitorización hemodinámica hasta la resolución de los síntomas y durante un mínimo de 3 días. Interrumpir el tratamiento con Tibsovo si los signos/síntomas graves persisten durante más de 48 horas tras el inicio de los corticosteroides sistémicos. Reanudar el tratamiento con 500 mg de ivosidenib una vez al día cuando los signos/síntomas sean moderados o menores y tras la mejoría del estado clínico. |
| Leucocitosis (recuento de glóbulos blancos > 25 x 109/l o un aumento absoluto del recuento total de glóbulos blancos > 15 x 109/l con respecto al valor inicial, ver secciones 4.4 y 4.8) | Iniciar el tratamiento con hidroxicarbamida de acuerdo con los protocolos de atención institucional e iniciar leucoaféresis según se indique clínicamente. Disminuya la hidroxicarbamida sólo tras la mejoría o resolución de la leucocitosis. La interrupción prematura puede provocar una recidiva. Interrumpir el tratamiento con Tibsovo si la leucocitosis no ha mejorado después de iniciar la hidroxicarbamida. Reanudar el tratamiento con 500 mg de ivosidenib una vez al día cuando se haya resuelto la leucocitosis. |
| Prolongación del intervalo QTc ˃ 480 a 500 ms. (Grado 2, ver secciones 4.4, 4.5 y 4.8) | Monitorizar y suplementar los niveles de electrolitos según se indique clínicamente. Revisar y ajustar los medicamentos concomitantes con efectos conocidos de prolongación del intervalo QTc (ver sección 4.5). Interrumpir el tratamiento con Tibsovo hasta que el intervalo QTc vuelva a ser ≤ 480 ms. Reanudar el tratamiento con 500 mg de ivosidenib una vez al día después de que el intervalo QTc vuelva a ser ≤ 480 ms. Monitorizar los ECGs semanalmente durante al menos 3 semanas y según se indique clínicamente tras el retorno del intervalo QTc a ≤ 480 ms. |
| Prolongación del intervalo QTc ˃ 500 ms. (Grado 3, ver secciones 4.4, 4.5 y 4.8) | Monitorizar y suplementar los niveles de electrolitos según se indique clínicamente. Revisar y ajustar los medicamentos concomitantes con efectos conocidos de prolongación del intervalo QTc (ver sección 4.5). Interrumpir el tratamiento con Tibsovo y monitorizar el ECG cada 24 h hasta que el intervalo QTc vuelva a estar dentro de los 30 ms del valor basal o ≤ 480 ms. En caso de prolongación del intervalo QTc > 550 ms, además de la interrupción del tratamiento con ivosidenib ya programada, considerar someter al paciente a estrecha monitorización electrocardiográfica continua hasta que el intervalo QTc vuelva a valores < 500 ms. Reanudar el tratamiento con 250 mg de ivosidenib una vez al día después de que el intervalo QTc vuelva a estar dentro de los 30 ms del valor basal o ≤ 480 ms. Monitorizar los ECGs semanalmente durante al menos 3 semanas y según se indique clínicamente después de que el intervalo QTc vuelva a estar dentro de los 30 ms del valor basal o ≤ 480 ms. Si se identifica una etiología alternativa para la prolongación del intervalo QTc, la dosis puede aumentarse a 500 mg de ivosidenib una vez al día. |
| Prolongación del intervalo QTc con signos/síntomas de arritmia ventricular potencialmente mortal (Grado 4, ver secciones 4.4, 4.5 y 4.8) | Interrumpir el tratamiento de forma permanente. |
| Otras reacciones adversas de grado 3 o superior | Interrumpir el tratamiento con Tibsovo hasta que la toxicidad se resuelva a grado 1 o inferior, o al nivel inicial, y luego reanudar con 500 mg diarios (toxicidad de grado 3) o 250 mg diarios (toxicidad de grado 4). Si se repite la toxicidad de grado 3 (por segunda vez), reducir la dosis de Tibsovo a 250 mg diarios hasta que se resuelva la toxicidad, y luego reanudar a 500 mg diarios. Si la toxicidad de grado 3 se repite (por tercera vez), o la toxicidad de grado 4 se repite, suspender el tratamiento con Tibsovo. |
El grado 1 es leve, el grado 2 es moderado, el grado 3 es grave y el grado 4 es potencialmente mortal.
Poblaciones especiales
Pacientes de edad avanzada
No es necesario ajustar la dosis en pacientes de edad avanzada (≥ 65 años, ver secciones 4.8 y 5.2). No se dispone de datos en pacientes de 85 años de edad o mayores.
Insuficiencia renal
No es necesario ajustar la dosis en pacientes con insuficiencia renal leve
(TFGe ≥ 60 a ˂ 90 ml/min/1,73 m2) o moderada (TFGe ≥ 30 a ˂ 60 ml/min/1,73 m2). No se ha determinado una dosis recomendada para pacientes con insuficiencia renal grave
(TFGe ˂ 30 ml/min/1,73 m2). Tibsovo se debe utilizar con precaución en pacientes con insuficiencia
renal grave y esta población de pacientes debe ser monitorizada estrechamente
(ver secciones 4.4 y 5.2).
Insuficiencia hepática
No es necesario ajustar la dosis en pacientes con insuficiencia hepática leve (clase A de Child-Pugh). No se ha determinado una dosis recomendada para pacientes con insuficiencia hepática moderada y grave (clases B y C de Child-Pugh). Tibsovo se debe utilizar con precaución en pacientes con insuficiencia hepática moderada y grave, y esta población de pacientes debe ser monitorizada estrechamente (ver secciones 4.4 y 5.2).
Población pediátrica
No se ha establecido la seguridad y eficacia de Tibsovo en niños y adolescentes menores de 18 años de edad. No se dispone de datos.
Forma de administración
Tibsovo se administra por vía oral.
Los comprimidos se toman una vez al día aproximadamente a la misma hora. Los pacientes no deben comer nada durante 2 horas antes y 1 hora después de tomar los comprimidos (ver sección 5.2). Los comprimidos se deben tragar enteros con agua.
Se debe aconsejar a los pacientes que eviten el pomelo y el zumo de pomelo durante el tratamiento (ver sección 4.5). También se debe advertir a los pacientes que no traguen el gel de sílice desecante que se encuentra en el frasco de los comprimidos (ver sección 6.5).
4.3 Contraindicaciones
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Administración concomitante con inductores potentes del CYP3A4 o dabigatrán (ver sección 4.5). Síndrome del QT largo congénito.
Antecedentes familiares de muerte súbita o arritmia ventricular polimórfica.
Intervalo QT/QTc > 500 ms, independientemente del método de corrección (ver secciones 4.2 y 4.4).
4.4 Advertencias y precauciones especiales de empleo
Síndrome de diferenciación en pacientes con leucemia mieloide aguda
Se ha notificado síndrome de diferenciación tras el tratamiento con ivosidenib (ver sección 4.8). El síndrome de diferenciación puede poner en riesgo la vida o ser mortal si no se trata (ver abajo y sección 4.2). El síndrome de diferenciación se asocia a una proliferación y diferenciación rápida de las células mieloides. Los síntomas incluyen: leucocitosis no infecciosa, edema periférico, pirexia, disnea, derrame pleural, hipotensión, hipoxia, edema pulmonar, neumonitis, derrame pericárdico, erupción cutánea, sobrecarga de líquidos, síndrome de lisis tumoral y aumento de la creatinina.
Los pacientes deben ser informados de los signos y síntomas del síndrome de diferenciación, aconsejar que contacten con su médico inmediatamente si éstos se producen, y sobre la necesidad de llevar la Tarjeta de información para el paciente consigo en todo momento.
Si se sospecha un síndrome de diferenciación, administrar corticoides sistémicos e iniciar la monitorización hemodinámica hasta la resolución de los síntomas y durante un mínimo de 3 días.
Si se observa leucocitosis, iniciar el tratamiento con hidroxicarbamida de acuerdo con los protocolos de atención institucional y leucoaféresis según se indique clínicamente (ver sección 4.5).
Reducir la dosis de corticosteroides e hidroxicarbamida sólo después de la resolución de los síntomas. Los síntomas del síndrome de diferenciación pueden reaparecer con la interrupción prematura del tratamiento con corticosteroides y/o hidroxicarbamida. Interrumpir el tratamiento con Tibsovo si los signos/síntomas graves persisten durante más de 48 horas después del inicio de los corticosteroides sistémicos, y reanudar el tratamiento con 500 mg de ivosidenib una vez al día cuando los signos/síntomas sean moderados o menores y tras la mejoría del estado clínico del paciente.
Prolongación del intervalo QTc
Se ha notificado una prolongación del intervalo QTc tras el tratamiento con ivosidenib (ver sección 4.8).
Se debe realizar un ECG antes de iniciar el tratamiento, al menos semanalmente durante las primeras
3 semanas de tratamiento y posteriormente una vez al mes si el intervalo QTc permanece ≤ 480 ms (ver sección 4.2). Cualquier anomalía debe ser tratada inmediatamente (ver sección 4.2). En caso de sintomatología sugestiva, se debe realizar un ECG según clínicamente indicado. En caso de vómitos y/o diarrea graves, se debe realizar una evaluación de alteraciones en los electrolitos séricos, especialmente de la hipopotasemia y del magnesio.
Se debe informar a los pacientes del riesgo de prolongación del intervalo QT, de sus signos y síntomas (palpitaciones, mareo, síncope o incluso parada cardíaca) y se les debe aconsejar que se pongan en contacto con su médico inmediatamente si se producen.
La administración concomitante con medicamentos que prolongan el intervalo QTc, o con inhibidores moderados o potentes del CYP3A4 puede aumentar el riesgo de prolongación del intervalo QTc y se debe evitar siempre que sea posible durante el tratamiento con Tibsovo. Si no es posible el uso de una alternativa adecuada, los pacientes deben ser tratados con precaución y monitorizados estrechamente por la prolongación del intervalo QTc. Se debe realizar un ECG antes de la coadministración, realizar un seguimiento semanal durante al menos 3 semanas y luego según esté clínicamente indicado. La dosis recomendada de ivosidenib se debe reducir a 250 mg una vez al día si no se puede evitar el uso de inhibidores moderados o potentes del CYP3A4 (ver secciones 4.2 y 4.5).
Si la administración de furosemida (un sustrato de OAT3) está clínicamente indicada para controlar los signos/síntomas del síndrome de diferenciación, los pacientes deben ser monitorizados estrechamente para detectar desequilibrios electrolíticos y prolongación del intervalo QTc.
Los pacientes con insuficiencia cardíaca congestiva o anomalías electrolíticas deben ser vigilados estrechamente, con controles periódicos de ECG y electrolitos, durante el tratamiento con ivosidenib. El tratamiento con Tibsovo se debe interrumpir permanentemente si los pacientes desarrollan una prolongación del intervalo QTc con signos o síntomas de arritmia potencialmente mortal
(ver sección 4.2).
Ivosidenib se debe utilizar con precaución en pacientes con niveles de albúmina por debajo del rango normal, o bien con peso más bajo del normal.
Insuficiencia renal grave
No se ha establecido la seguridad y eficacia de ivosidenib en pacientes con insuficiencia renal grave (TFGe ˂ 30 ml/min/1,73 m2). Tibsovo se debe utilizar con precaución en pacientes con insuficiencia renal grave y esta población de pacientes debe ser monitorizada estrechamente
(ver secciones 4.2 y 5.2).
Insuficiencia hepática
No se ha establecido la seguridad y eficacia de ivosidenib en pacientes con insuficiencia hepática moderada y grave (clases B y C de Child-Pugh). Tibsovo se debe utilizar con precaución en pacientes con insuficiencia hepática moderada y grave, y esta población de pacientes debe ser monitorizada estrechamente (ver secciones 4.2 y 5.2).
Tibsovo se debe utilizar con precaución en pacientes con insuficiencia hepática leve (clase A de Child- Pugh) (ver sección 4.8).
Sustratos del CYP3A4
Ivosidenib induce el CYP3A4 y podría, por lo tanto, disminuir la exposición sistémica a los sustratos del CYP3A4.
Los pacientes deben ser monitorizados para detectar la pérdida de eficacia antifúngica si no se puede evitar el uso de itraconazol o ketoconazol (ver sección 4.5).
Mujeres en edad fértil / anticoncepción
Las mujeres en edad fértil deben someterse a una prueba de embarazo antes de iniciar el tratamiento con Tibsovo y evitar quedarse embarazadas durante el tratamiento (ver sección 4.6).
Las mujeres en edad fértil y los hombres con parejas femeninas en edad fértil deben utilizar métodos anticonceptivos eficaces durante el tratamiento con Tibsovo y durante, al menos, 1 mes después de la última dosis.
Ivosidenib puede disminuir las concentraciones sistémicas de los anticonceptivos hormonales y, por tanto, se recomienda el uso concomitante de un método anticonceptivo de barrera
(ver secciones 4.5 y 4.6).
Intolerancia a la lactosa
Tibsovo contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, deficiencia total de lactasa o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
Contenido en sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por comprimido; esto es, esencialmente "exento de sodio”.
4.5 Interacción con otros medicamentos y otras formas de interacción
Efecto de otros medicamentos sobre ivosidenib
Inductores potentes del CYP3A4
Ivosidenib es sustrato del CYP3A4. Es previsible que la administración concomitante con inductores potentes del CYP3A4 (por ejemplo, carbamazepina, fenobarbital, fenitoína, rifampicina, hierba de San Juan (Hypericum perforatum)) disminuya las concentraciones plasmáticas de ivosidenib, y está
contraindicada durante el tratamiento con Tibsovo (ver sección 4.3). No se han realizado estudios clínicos que evalúen la farmacocinética de ivosidenib en presencia de un inductor del CYP3A4.
Inhibidores moderados o potentes del CYP3A4
En individuos sanos, la administración de una dosis única de 250 mg de ivosidenib y 200 mg de itraconazol una vez al día durante 18 días aumentó el AUC de ivosidenib en un 169% (IC del
90%: 145, 195) sin cambios en la Cmax. La administración concomitante de inhibidores moderados o potentes del CYP3A4 aumenta las concentraciones plasmáticas de ivosidenib. Esto puede aumentar el riesgo de prolongación del intervalo QTc y siempre que sea posible se deben considerar alternativas adecuadas que no sean inhibidores moderados o potentes del CYP3A4 durante el tratamiento con Tibsovo. Si no es posible el uso de una alternativa adecuada los pacientes deben ser tratados con
precaución y ser estrechamente monitorizados por la prolongación del intervalo QTc. Si no se puede
evitar el uso de inhibidores moderados o potentes del CYP3A4, la dosis recomendada de ivosidenib debe reducirse a 250 mg una vez al día (ver secciones 4.2 y 4.4).
Los inhibidores moderados del CYP3A4 son: aprepitant, ciclosporina, diltiazem, eritromicina, fluconazol, pomelo y zumo de pomelo, isavuconazol, verapamilo.
Los inhibidores potentes del CYP3A4 son: claritromicina, itraconazol, ketoconazol, posaconazol, ritonavir, voriconazol.
Medicamentos conocidos por prolongar el intervalo QTc
La administración concomitante con medicamentos que prolongan el intervalo QTc
(por ejemplo, antiarrítmicos, fluoroquinolonas, antagonistas de los receptores 5-HT3, antifúngicos triazoles) puede aumentar el riesgo de prolongación del intervalo QTc y se debe evitar siempre que sea posible durante el tratamiento con Tibsovo. Los pacientes deben ser tratados con precaución y ser estrechamente monitorizados por la prolongación del intervalo QTc si no es posible el uso de una alternativa adecuada (ver secciones 4.2 y 4.4).
Efecto de ivosidenib sobre otros medicamentos
Interacciones con transportadores
Ivosidenib inhibe la P-gp y tiene el potencial de inducirla. Por lo tanto, puede alterar la exposición sistémica de sustancias activas que son transportadas predominantemente por la P-gp
(por ejemplo, dabigatrán). La administración concomitante con dabigatrán está contraindicada (ver sección 4.3).
Ivosidenib inhibe la OAT3, el polipéptido transportador de aniones orgánicos 1B1 (OATP1B1) y el polipéptido transportador de aniones orgánicos 1B3 (OATP1B3). Por lo tanto, puede aumentar la exposición sistémica a los sustratos de OAT3 u OATP1B1/1B3. La administración concomitante de sustratos de OAT3 (por ejemplo, bencilpenicilina, furosemida) o sustratos sensibles a OATP1B1/1B3 (por ejemplo, atorvastatina, pravastatina, rosuvastatina) debe evitarse siempre que sea posible durante el tratamiento con Tibsovo (ver sección 5.2). Los pacientes se deben tratar con precaución si no es posible utilizar una alternativa adecuada. Si la administración de furosemida está clínicamente indicada para controlar los signos/síntomas del síndrome de diferenciación, los pacientes deben ser estrechamente monitorizados para detectar desequilibrios electrolíticos y prolongación del intervalo QTc.
Inducción enzimática
Enzimas del citocromo P450 (CYP)
Ivosidenib induce CYP3A4, CYP2B6, CYP2C8, CYP2C9 y puede inducir CYP2C19. Por lo tanto, puede disminuir la exposición sistémica a los sustratos de estas enzimas. Durante el tratamiento con Tibsovo se deben considerar alternativas adecuadas que no sean sustratos de CYP3A4, CYP2B6, CYP2C8 o CYP2C9 con estrecho margen terapéutico, o sustratos de CYP2C19. Los pacientes deben
ser vigilados por la pérdida de eficacia del sustrato si no se puede evitar el uso de dichos medicamentos (ver sección 5.2).
Los sustratos del CYP3A4 con estrecho margen terapéutico incluyen: alfentanilo, ciclosporina, everólimus, fentanilo, pimozida, quinidina, sirólimus, tacrólimus.
Los sustratos del CYP2B6 con estrecho margen terapéutico incluyen: ciclofosfamida, ifosfamida, metadona.
Los sustratos del CYP2C8 con estrecho margen terapéutico incluyen: paclitaxel, pioglitazona, repaglinida.
Los sustratos del CYP2C9 con estrecho margen terapéutico incluyen: fenitoína, warfarina.
Los sustratos del CYP2C19 incluyen: omeprazol.
El itraconazol o el ketoconazol no deben utilizarse de forma concomitante con Tibsovo debido a la esperada pérdida de eficacia antifúngica.
Ivosidenib puede disminuir las concentraciones sistémicas de los anticonceptivos hormonales y, por tanto, se recomienda el uso concomitante de un método anticonceptivo de barrera durante al menos
1 mes después de la última dosis (ver secciones 4.4 y 4.6).
Uridina difosfato glucuronosiltransferasas (UGTs)
Ivosidenib tiene el potencial de inducir las UGTs y puede, por lo tanto, disminuir la exposición sistémica de los sustratos de estas enzimas (por ejemplo, lamotrigina, raltegravir). Durante el tratamiento con Tibsovo se deben considerar alternativas adecuadas que no sean sustratos de UGT. Los pacientes deben ser vigilados por la pérdida de eficacia del sustrato UGT si no se puede evitar el uso de dichos medicamentos (ver sección 5.2).
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil/Anticoncepción
Las mujeres en edad fértil se deben someter a una prueba de embarazo antes de iniciar el tratamiento con Tibsovo y deben evitar quedarse embarazadas durante el tratamiento (ver sección 4.4).
Las mujeres en edad fértil y los hombres con parejas femeninas en edad fértil deben utilizar métodos anticonceptivos eficaces durante el tratamiento con Tibsovo y durante, al menos, 1 mes después de la última dosis.
Ivosidenib puede disminuir las concentraciones sistémicas de los anticonceptivos hormonales y, por lo tanto, se recomienda el uso concomitante de un método anticonceptivo alternativo como los anticonceptivos de barrera (ver secciones 4.4 y 4.5).
Embarazo
No se dispone de datos adecuados sobre el uso de ivosidenib en mujeres embarazadas. Los estudios en animales han mostrado toxicidad para la reproducción (ver sección 5.3).
No se recomienda el uso de Tibsovo durante el embarazo ni en mujeres en edad fértil que no utilicen métodos anticonceptivos eficaces. Los pacientes deben ser informados del riesgo potencial para el feto si se utiliza durante el embarazo o si una paciente (o la pareja femenina de un paciente masculino tratado) se queda embarazada durante el tratamiento o durante el período de un mes después de la última dosis.
Lactancia
Se desconoce si ivosidenib y sus metabolitos se excretan en la leche materna. No se han realizado estudios en animales para evaluar la excreción de ivosidenib y sus metabolitos en la leche. No se puede excluir el riesgo en lactantes.
Se debe interrumpir la lactancia durante el tratamiento con Tibsovo y durante, al menos, 1 mes después de la última dosis.
Fertilidad
No se dispone de datos en humanos sobre el efecto de ivosidenib en la fertilidad. No se han realizado estudios de fertilidad en animales para evaluar el efecto de ivosidenib. Se observaron efectos indeseables en los órganos reproductores en un estudio de toxicidad a dosis repetidas de 28 días
(ver sección 5.3). Se desconoce la relevancia clínica de estos efectos.
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de ivosidenib sobre la capacidad para conducir y utilizar máquinas es pequeña. En algunos pacientes que recibían ivosidenib se han notificado fatiga y mareo (ver sección 4.8), lo cual debe tenerse en cuenta al evaluar la capacidad del paciente para conducir o utilizar máquinas.
4.8 Reacciones adversas
Leucemia mieloide aguda de nuevo diagnóstico en combinación con azacitidina
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes fueron vómitos (40%), neutropenia (31%), trombocitopenia
(28%), prolongación del intervalo QT del electrocardiograma (21%), insomnio (19%).
Las reacciones adversas graves más frecuentes fueron el síndrome de diferenciación (8%) y trombocitopenia (3%).
En los pacientes tratados con ivosidenib en combinación con azacitidina, la frecuencia de suspensión del tratamiento con ivosidenib debido a reacciones adversas fue del 6%. Las reacciones adversas que condujeron a la suspensión fueron prolongación del intervalo QT del electrocardiograma (1%), insomnio (1%), neutropenia (1%) y trombocitopenia (1%).
La frecuencia de interrupción de la dosis de ivosidenib debido a reacciones adversas fue del 35%. Las reacciones adversas más frecuentes que dieron lugar a la interrupción de la dosis fueron neutropenia (24%), prolongación del intervalo QT del electrocardiograma (7%), trombocitopenia (7%), leucopenia (4%) y síndrome de diferenciación (3%).
La frecuencia de reducción de la dosis de ivosidenib debido a reacciones adversas fue del 19%. Las reacciones adversas que condujeron a la reducción de la dosis fueron prolongación del intervalo QT del electrocardiograma (10%), neutropenia (8%) y trombocitopenia (1%).
Tabla de reacciones adversas
Las frecuencias de las reacciones adversas se basan en el estudio AG120-C-009 que incluyó a
72 pacientes con LMA de nuevo diagnóstico aleatorizados y tratados con ivosidenib (500 mg diarios)
en combinación con azacitidina. La mediana de la duración del tratamiento con Tibsovo fue de
8 meses (rango de 0,1 a 40,0 meses). Las frecuencias de las reacciones adversas se basan en las frecuencias de los acontecimientos adversos por todas las causas, de los cuales, una proporción de los
acontecimientos para una reacción adversa se puede deber a otras causas distintas a ivosidenib, como la propia enfermedad, otros medicamentos o causas no relacionadas.
Las frecuencias se definen como: muy frecuentes (≥ 1/10); frecuentes (≥ 1/100 a < 1/10); poco frecuentes (≥ 1/1 000 a < 1/100); raras (≥ 1/10 000 a < 1/1 000); muy raras (< 1/10 000). Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden de gravedad decreciente.
Tabla 2 - Reacciones adversas al medicamento notificadas en pacientes con LMA de nuevo diagnóstico tratados con ivosidenib en combinación con azacitidina en el estudio clínico AG120-C-009 (N=72)
| Clasificación por órganos y sistemas | Frecuencia | Reacciones adversas |
| Trastornos de la sangre y del sistema linfático | Muy frecuentes | Síndrome de diferenciación, leucocitosis, trombocitopenia, neutropenia |
| Trastornos de la sangre y del sistema linfático | Frecuentes | Leucopenia |
| Trastornos psiquiátricos | Muy frecuentes | Insomnio |
| Trastornos del sistema nervioso | Muy frecuentes | Cefalea, mareo |
| Trastornos del sistema nervioso | Frecuentes | Neuropatía periférica |
| Trastornos gastrointestinales | Muy frecuentes | Vómitos1 |
| Trastornos gastrointestinales | Frecuentes | Dolor orofaríngeo |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Muy frecuentes | Dolor en una extremidad, artralgia, dolor de espalda |
| Exploraciones complementarias | Muy frecuentes | Intervalo QT del electrocardiograma prolongado |
1 El término agrupado incluye vómitos y arcadas.
Colangiocarcinoma localmente avanzado o metastásico, previamente tratado
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes fueron fatiga (43%), náuseas (42%), dolor abdominal (35%), diarrea (35%), disminución del apetito (24%), ascitis (23%), vómitos (23%), anemia (19%) y erupción cutánea (15%).
Las reacciones adversas graves más frecuentes fueron ascitis (2%), hiperbilirrubinemia (2%) e ictericia colestática (2%).
En los pacientes tratados con ivosidenib, la frecuencia de suspensión del tratamiento debido a reacciones adversas fue del 2%. Las reacciones adversas que condujeron a la suspensión fueron ascitis (1%) e hiperbilirrubinemia (1%).
La frecuencia de interrupción de la dosis de ivosidenib debido a reacciones adversas fue del 16%. Las reacciones adversas más frecuentes que dieron lugar a la interrupción de la dosis fueron hiperbilirrubinemia (3%), aumento de la alanina aminotransferasa (3%), aumento de la aspartato aminotransferasa (3%), ascitis (2%) y fatiga (2%).
La frecuencia de reducción de la dosis de ivosidenib debido a reacciones adversas fue del 4%. Las reacciones adversas que condujeron a la reducción de la dosis fueron la prolongación del intervalo QT del electrocardiograma (3%) y la neuropatía periférica (1%).
Tabla de reacciones adversas
Las frecuencias de las reacciones adversas se basan en el estudio AG120-C-005 que incluyó a 123 pacientes con colangiocarcinoma localmente avanzado o metastásico, previamente tratado, aleatorizados y tratados con 500 mg de ivosidenib una vez al día. La mediana de la duración del
tratamiento con Tibsovo fue de 2,8 meses (rango de 0,1 a 45,1 meses; media (desviación estándar
[DE]) de 6,7 (8,2) meses).
Las frecuencias de las reacciones adversas se basan en las frecuencias de los acontecimientos adversos por todas las causas, donde una proporción de los acontecimientos de una reacción adversa puede
tener otras causas distintas a ivosidenib, como la enfermedad, otros medicamentos o causas no relacionadas.
Las frecuencias se definen como: muy frecuentes (≥ 1/10); frecuentes (≥ 1/100 a < 1/10); poco frecuentes (≥ 1/1 000 a < 1/100); raras (≥ 1/10 000 a < 1/1 000); muy raras (< 1/10 000). Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden de gravedad decreciente.
Tabla 3 - Reacciones adversas al fármaco notificadas en pacientes con colangiocarcinoma localmente avanzado o metastásico tratados con ivosidenib en el estudio clínico AG120-C-005 (N=123)
| Clasificación por órganos y sistemas | Frecuencia | Reacciones adversas |
| Trastornos de la sangre y del sistema linfático | Muy frecuentes | Anemia |
| Trastornos del metabolismo y la nutrición | Muy frecuentes | Apetito disminuido |
| Trastornos del sistema nervioso | Muy frecuentes | Neuropatía periférica, cefalea |
| Trastornos gastrointestinales | Muy frecuentes | Ascitis, diarrea, vómitos, náuseas, dolor abdominal |
| Trastornos hepatobiliares | Frecuentes | Ictericia colestática, hiperbilirrubinemia |
| Trastornos de la piel y del tejido subcutáneo | Muy frecuentes | Erupción1 |
| Trastornos generales y alteraciones en el lugar de administración | Muy frecuentes | Fatiga |
| Trastornos generales y alteraciones en el lugar de administración | Frecuentes | Caída |
| Exploraciones complementarias | Muy frecuentes | Aspartato aminotransferasa elevada, bilirrubina en sangre elevada |
| Exploraciones complementarias | Frecuentes | Intervalo QT del electrocardiograma prolongado, alanina aminotransferasa aumentada, recuento de leucocitos disminuido, recuento de plaquetas disminuido |
1 El término agrupado incluye erupción, erupción maculopapular, eritema, erupción macular, dermatitis exfoliativa generalizada, erupción medicamentosa e hipersensibilidad a fármaco.
Descripción de las reacciones adversas seleccionadas
Síndrome de diferenciación en pacientes con leucemia mieloide aguda (ver secciones 4.2 y 4.4)
En el estudio AG120-C-009, en los 72 pacientes con LMA de nuevo diagnóstico tratados con Tibsovo en combinación con azacitidina, el 14% experimentó síndrome de diferenciación. Ningún paciente suspendió el tratamiento con ivosidenib debido al síndrome de diferenciación y en una minoría de pacientes fueron necesarias las interrupciones de dosis (3%) para controlar los signos/síntomas. De los
10 pacientes que experimentaron el síndrome de diferenciación, todos se recuperaron después del tratamiento o tras la interrupción de la dosis de Tibsovo. La mediana del tiempo transcurrido hasta la aparición del síndrome de diferenciación fue de 20 días. El síndrome de diferenciación apareció a partir de los 3 días y hasta 46 días después del inicio del tratamiento durante la terapia en combinación.
Prolongación del intervalo QTc (ver secciones 4.2, 4.4 y 4.5)
En el estudio AG120-C-009, de los 72 pacientes con LMA de nuevo diagnóstico tratados con ivosidenib en combinación con azacitidina, el 21% notificó una prolongación del intervalo QT en el electrocardiograma; el 11% experimentó reacciones de grado 3 o superior. Según el análisis de los ECG, en el 15% de los pacientes tratados con ivosidenib en combinación con azacitidina, a los que se les realizó al menos una evaluación del ECG posterior al inicio, se observó un intervalo QTc
˃ 500 ms, y en el 24% se produjo un aumento del QTc ˃ 60 ms con respecto al valor inicial. El 1% de los pacientes suspendió el tratamiento con ivosidenib debido a la prolongación del intervalo QT en el electrocardiograma, se requirió la interrupción y la reducción de la dosis en el 7% y 10% de los pacientes, respectivamente. La mediana del tiempo hasta la aparición de la prolongación del intervalo QT en los pacientes tratados con ivosidenib fue de 29 días. La prolongación del intervalo QT en el electrocardiograma se produjo a partir de 1 día y hasta 18 meses después del inicio del tratamiento.
En el estudio AG120-C-005, de los 123 pacientes con colangiocarcinoma localmente avanzado o metastásico tratados con ivosidenib en monoterapia, el 10% notificó una prolongación del intervalo
QT en el electrocardiograma; el 2% experimentó reacciones de grado 3 o superior. Según el análisis de los ECG, el 2% de los pacientes tuvo un intervalo QTc ˃ 500 ms y el 5% una prolongación del intervalo QTc ˃ 60 ms con respecto al valor inicial. En el 3% de los pacientes fue necesario reducir la
dosis para controlar los signos/síntomas. La mediana del tiempo hasta la aparición de la prolongación
del intervalo QT en los pacientes tratados con ivosidenib en monoterapia fue de 28 días. La prolongación del intervalo QT del electrocardiograma se produjo a partir de 1 día y hasta 23 meses después del inicio del tratamiento.
Poblaciones especiales
Insuficiencia hepática
No se ha establecido la seguridad y eficacia de ivosidenib en pacientes con insuficiencia hepática moderada y grave (clases B y C de Child-Pugh). Se ha observado una tendencia a una mayor
incidencia de reacciones adversas en pacientes con insuficiencia hepática leve (clase A de Child-Pugh) (Ver secciones 4.2 y 5.2.).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
En caso de sobredosis, es probable que la toxicidad se manifieste como una exacerbación de las reacciones adversas asociadas a ivosidenib (ver sección 4.8). Los pacientes deben ser vigilados estrechamente y recibir el tratamiento sintomático adecuado (ver secciones 4.2 y 4.4). No existe un antídoto específico para la sobredosis de ivosidenib.
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos; otros agentes antineoplásicos
Código ATC: L01XX62
Mecanismo de acción
Ivosidenib es un inhibidor de la enzima IDH1 mutada. La IDH1 mutada convierte el alfa-cetoglutarato (α-KG) en 2-hidroxiglutarato (2-HG), que bloquea la diferenciación celular y favorece la carcinogénesis en neoplasias malignas tanto hematológicas como no hematológicas. El mecanismo de acción de ivosidenib, más allá de su capacidad para reducir el 2-HG y restaurar la diferenciación celular, no se conoce por completo en todas las indicaciones.
Efectos farmacodinámicos
La administración de múltiples dosis de 500 mg de ivosidenib al día redujeron las concentraciones plasmáticas de 2-HG en pacientes con neoplasias malignas hematológicas y colangiocarcinoma con mutación IDH1 hasta niveles aproximados a los observados en individuos sanos. En la médula ósea de los pacientes con neoplasias malignas hematológicas y en la biopsia tumoral de los pacientes con colangiocarcinoma, la reducción media (% del coeficiente de variación [%CV]) de las concentraciones de 2-HG fue del 93,1% (11,1%) y del 82,2% (32,4%), respectivamente.
Utilizando un modelo de concentración de ivosidenib-QTc, se predijo una prolongación del intervalo QTc dependiente de la concentración de aproximadamente 17,2 ms (IC del 90%: 14,7, 19,7) en el estado estacionario Cmax, en base a un análisis de 173 pacientes con LMA que recibieron 500 mg de ivosidenib una vez al día. Se observó una prolongación del intervalo QTc dependiente de la concentración de aproximadamente 17,2 ms (IC del 90%: 14,3, 20,2) en el estado estacionario Cmax tras una dosis de 500 mg al día, en base a un análisis de 101 pacientes con colangiocarcinoma que recibieron ivosidenib 500 mg al día (ver secciones 4.2 y 4.4).
Eficacia clínica
Leucemia mieloide aguda de nuevo diagnóstico en combinación con azacitidina
La eficacia y seguridad de Tibsovo se evaluaron en un estudio clínico multicéntrico, aleatorizado, doble ciego y controlado con placebo (AG120-C-009) de 146 pacientes adultos con LMA no tratada previamente con una mutación IDH1, que no eran candidatos para recibir quimioterapia de inducción intensiva en base a, al menos, uno de los siguientes criterios: 75 años o mayores, estado funcional del Grupo Oncológico Cooperativo del Este (ECOG, por sus siglas en inglés) de 2, enfermedad cardíaca o pulmonar grave, insuficiencia hepática con bilirrubina > 1,5 veces el límite superior de la normalidad, aclaramiento de creatinina < 45 ml/min, u otra comorbilidad. En todos los individuos se realizaron análisis de mutaciones genéticas para la confirmación centralizada de la mutación IDH1, a partir de médula ósea y/o sangre periférica utilizando el sistema Abbott RealTime™ IDH1. Los pacientes fueron asignados aleatoriamente a recibir Tibsovo 500 mg o el placebo correspondiente por vía oral
una vez al día, con azacitidina 75 mg/m2/día por vía subcutánea o intravenosa durante 1 semana cada 4
semanas, hasta el final del estudio, la progresión de la enfermedad o una toxicidad inaceptable.
La mediana de la edad de los pacientes tratados con Tibsovo fue de 76 años (rango: 58 a 84); el 58%
eran hombres; el 21% eran de raza asiática, el 17% blanca, y del 61% no se informó; y tenían un
estado funcional ECOG de 0 (19%), 1 (44%) o 2 (36%). El 75% de los pacientes tenían LMA de novo. En general, los pacientes tenían un riesgo citogenético documentado favorable (4%), intermedio (67%) o desfavorable/otro (26%) según la evaluación de los investigadores basada en las guías de práctica clínica en oncología de la Red Nacional Integral del Cáncer (NCCN, por sus siglas en inglés) (2017).
La eficacia se basó en la variable primaria de eficacia de supervivencia libre de eventos (SLE), medida desde la fecha de aleatorización hasta el fracaso del tratamiento, recaída tras remisión o muerte por cualquier causa. El fracaso del tratamiento se definió como la imposibilidad de alcanzar la remisión completa (RC) en la semana 24. La supervivencia global (SG), la tasa de RC, la tasa de RC + RC con recuperación hematológica parcial (RC + RCh) y la tasa de respuesta objetiva (TRO) fueron variables secundarias de eficacia cruciales (Tabla 4 y Figura 1).
Tabla 4 - Resultados de eficacia en pacientes con LMA de nuevo diagnóstico en combinación con azacitidina
| Variable | Ivosidenib (500 mg al día) + azacitidina N=72 | Placebo + azacitidina N=74 |
| Supervivencia libre de eventos, eventos (%) Fracaso del tratamiento Recaída Muerte | 46 (63,9) 42 (58,3) 3 (4,2) 1 (1,4) | 62 (83,8) 59 (79,7) 2 (2,7) 1 (1,4) |
| Hazard ratio1 (IC 95%) | 0,33 (0,16; 0,69) | |
| Eventos de SG (%) | 28 (38,9) | 46 (62,2) |
| Mediana de la SG (IC 95%) meses | 24,0 (11,3; 34,1) | 7,9 (4,1; 11,3) |
| Hazard ratio1 (IC 95%) | 0,44 (0,27; 0,73) | |
| RC, n (%) | 34 (47,2) | 11 (14,9) |
| IC 95%2 | (35,3; 59,3) | (7,7; 25,0) |
| Odds ratio3 (IC 95%) | 4,76 (2,15; 10,50) | |
| Tasa de RC + RCh, n (%) | 38 (52,8) | 13 (17,6) |
| IC 95%2 | (40,7; 64,7) | (9,7; 28,2) |
| Odds ratio3 (IC 95%) | 5,01 (2,32; 10,81) | |
| Tasa de RC + RCi, n (%) | 39 (54,2) | 12 (16,2) |
| IC 95%2 | (42,0; 66,0) | (8,7; 26,6) |
| Odds ratio3 (IC 95%) | 5,90 (2,69; 12,97) |
IC: intervalo de confianza; RC = remisión completa; RCh = remisión completa con recuperación hematológica parcial; RCi = remisión completa con recuperación hematológica incompleta; SG = supervivencia global; RP = respuesta parcial.
1 Hazard ratio se estimó mediante un modelo de riesgos proporcionales de Cox estratificado por los factores de
estratificación aleatorizados (estado de la LMA y región geográfica) con PBO+AZA como denominador.
2 IC del porcentaje se calcula con el método de Clopper y Pearson (Binomio exacto).
3 La estimación de Cochran-Mantel-Haenszel (CMH) para la odds ratio se calcula con PBO+AZA como denominador.
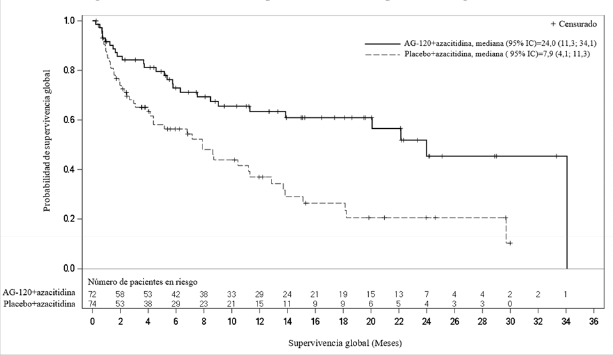
Figura 1: Gráfico de Kaplan Meier de la supervivencia global (SG)
AG120=ivosidenib
Un análisis actualizado de la SG, realizado en el 64,2% (N = 95) de los eventos, confirmó el beneficio en la supervivencia global de Tibsovo en combinación con azacitidina en comparación con placebo en combinación con azacitidina, con una mediana de SG de 29,3 meses frente a 7,9 meses, respectivamente (HR = 0,42; IC del 95%: 0,27 a 0,65).
Colangiocarcinoma localmente avanzado o metastásico previamente tratado
La eficacia de Tibsovo se evaluó en un ensayo clínico de fase 3 aleatorizado (2:1), multicéntrico, doble ciego, controlado con placebo (estudio AG120-C-005), en 185 pacientes adultos con colangiocarcinoma localmente avanzado o metastásico con una mutación IDH1 R132, cuya enfermedad había progresado después de al menos 1 pero no más de 2 regímenes de tratamiento previos que incluían como mínimo un régimen con gemcitabina o 5-FU y una expectativa de supervivencia ≥ 3 meses.
Los pacientes fueron aleatorizados para recibir Tibsovo 500 mg por vía oral una vez al día o el placebo correspondiente hasta la progresión de la enfermedad o el desarrollo de una toxicidad inaceptable. La aleatorización se estratificó en función del número de tratamientos previos (1 o 2). Los pacientes candidatos que fueron asignados aleatoriamente al placebo tuvieron la posibilidad de cambiar al tratamiento con Tibsovo tras la progresión de la enfermedad confirmada mediante revisión radiológica según evaluación del investigador. En todos los individuos se realizaron análisis de mutaciones genéticas para la confirmación centralizada de la mutación IDH1 a partir de una biopsia de tejido tumoral, utilizando la prueba OncomineTM Dx Target.
La mediana de edad fue de 62 años (rango: 33 a 83). La mayoría de los pacientes eran mujeres (63%), el 57% eran de raza blanca y el 37% tenían un estado funcional ECOG de 0 (37%) o 1 (62%). Todos los pacientes recibieron, al menos, una línea de tratamiento sistémica previa y el 47% recibió dos líneas previas. La mayoría de los pacientes tenían colangiocarcinoma intrahepático (91%) en el momento del diagnóstico y el 92% tenía enfermedad metastásica. En ambos brazos, el 70% de los pacientes tenía una mutación R132C, el 15% una mutación R132L, el 12% una mutación R132G, el
1,6% una mutación R132S y el 1,1% una mutación R132H.
La variable primaria de eficacia fue la supervivencia libre de progresión (SLP) determinada por el Centro de Radiología Independiente (IRC, por sus siglas en inglés) según los Criterios de Evaluación de la Respuesta en Tumores Sólidos (RECIST, por sus siglas en inglés) v1.1, que se definió como el tiempo transcurrido desde la aleatorización hasta la progresión de la enfermedad o la muerte por cualquier causa.
La supervivencia global (SG) fue una variable de eficacia secundaria. Según lo permitido por el protocolo, una gran proporción (70,5%) de los pacientes del brazo de placebo pasaron a recibir Tibsovo tras la progresión radiográfica de la enfermedad, según la evaluación del investigador.
Los resultados de eficacia se resumen en la Tabla 5.
Tabla 5 - Resultados de eficacia en pacientes con colangiocarcinoma localmente avanzado o metastásico
| Tasa de SLP (%)3 6 meses 12 meses | 32,0 21,9 | NE NE |
| Ivosidenib (500 mg al día) | Placebo | |
| Supervivencia global4 | N=126 | N=61 |
| Muertes, n (%) | 100 (79) | 50 (82) |
| Mediana de la SG (meses, IC 95%) | 10,3 (7,8; 12,4) | 7,5 (4,8; 11,1) |
| Hazard ratio (IC 95%)1 Valor p2 | 0,79 (0,56; 1,12) 0,093 |
IRC: Centro Radiológico Independiente; IC: Intervalo de Confianza; NE = no estimable.
1 Hazard ratio se calcula a partir del modelo de regresión de Cox estratificado. El factor de estratificación es el número de líneas terapéuticas previas en el momento de la aleatorización.
2 Valor p unilateral se calcula a partir de la prueba de rango logarítmico estratificada sin ajuste por el crossover. El factor de estratificación es el número de líneas terapéuticas previas en el momento de la
aleatorización.
3 Basado en la estimación de Kaplan-Meier. Ningún paciente aleatorizado a placebo logró una SLP de 6 meses o más.
4 Los resultados de la SG se basan en el análisis final de la SG (basado en 150 muertes; corte de datos: 30 de mayo de 2020) que se produjo 16 meses después del análisis final de la SLP (corte de datos: 31 de enero de
2019).
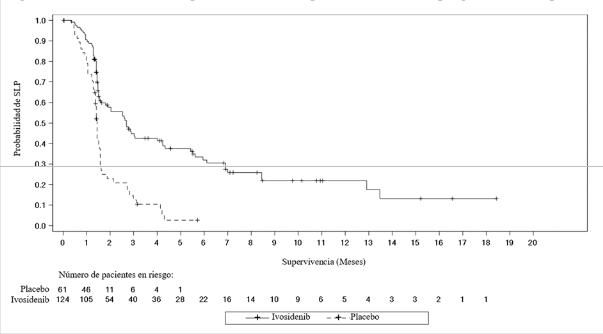
Figura 2: Gráfico de Kaplan Meier de la supervivencia libre de progresión (SLP) por IRC
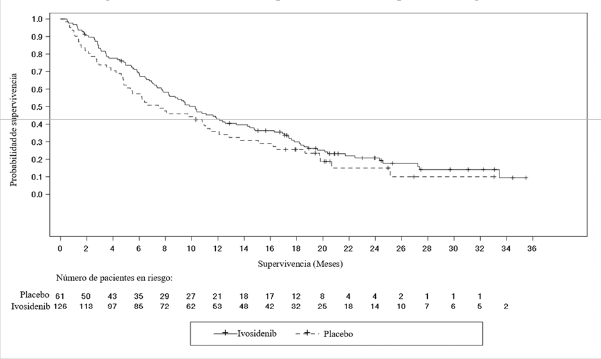
Figura 3: Gráfico de Kaplan-Meier de la supervivencia global
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Tibsovo en todos los grupos de la población pediátrica en el tratamiento de todas las afecciones incluidas en la categoría de neoplasias malignas (excepto los tumores del sistema nervioso central y las neoplasias del tejido hematopoyético y linfoide) y en el tratamiento de las neoplasias malignas del sistema nervioso central.
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Tibsovo en uno o más grupos de la población pediátrica en el tratamiento de la leucemia mieloide aguda (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Un total de 10 estudios clínicos han contribuido a la caracterización de la farmacología clínica de ivosidenib. Cinco estudios se han llevado a cabo en individuos sanos y 3 en pacientes con enfermedades malignas avanzadas, incluidos 2 estudios en pacientes con colangiocarcinoma. Se han realizado 2 estudios en pacientes con LMA de nuevo diagnóstico que recibieron ivosidenib en combinación con azacitidina. Los parámetros farmacocinéticos se han evaluado en plasma y orina. Los parámetros farmacodinámicos se han evaluado en plasma, orina, biopsia tumoral y médula ósea (sólo para los estudios en pacientes con neoplasias malignas avanzadas).
La farmacocinética en el estado estacionario de ivosidenib 500 mg fue comparable entre los pacientes con LMA de nuevo diagnóstico y con colangiocarcinoma.
Absorción
Tras una dosis oral única de 500 mg, la mediana del tiempo hasta la Cmax (Tmax) fue de aproximadamente 2 horas en pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib y azacitidina, y en pacientes con colangiocarcinoma.
En los pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib (dosis de
500 mg al día) y azacitidina, la Cmax media en el estado estacionario fue de 6 145 ng/ml (CV%: 34) y la media del AUC en estado estacionario fue de 106 326 ngꞏhr/ml (CV%: 41).
En pacientes con colangiocarcinoma, la Cmax media fue de 4 060 ng/ml (%CV: 45) tras una dosis única de 500 mg y de 4.799 ng/ml (CV%: 33) en el estado estacionario para 500 mg diarios. El AUC fue de
86 382 ngꞏhr/ml (CV%: 34).
Los ratios de acumulación fueron de aproximadamente 1,6 para el AUC y 1,2 para la Cmax en pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib y azacitidina, y de aproximadamente 1,5 para el AUC y 1,2 para la Cmax en pacientes con colangiocarcinoma, durante un mes, cuando se administraron 500 mg al día de ivosidenib. Los niveles plasmáticos en el estado estacionario se alcanzaron en los 14 días siguientes a la administración de una dosis diaria.
Se observaron aumentos significativos de la Cmax de ivosidenib (aproximadamente un 98%; IC del
90%: 79, 119) y del AUCinf (aproximadamente un 25%) tras la administración de una dosis única con una comida rica en grasas (aproximadamente de 900 a 1 000 calorías, 56% a 60% de grasa) en individuos sanos (ver sección 4.2).
Distribución
Según un análisis farmacocinético poblacional, el volumen medio aparente de distribución de ivosidenib en estado estacionario (Vc/F) es de 3,20 l/kg (CV%: 47,8) en pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib y azacitidina y de 2,97 l/kg (CV%: 25,9) en pacientes con colangiocarcinoma tratados con ivosidenib en monoterapia.
Biotransformación
Ivosidenib fue el componente predominante (> 92%) de la radiactividad total en el plasma de individuos sanos. Se metaboliza principalmente por vías oxidativas mediadas en gran medida por el CYP3A4, con contribuciones menores por las vías de N-desalquilación e hidrólisis.
Ivosidenib induce el CYP3A4 (incluyendo su propio metabolismo), el CYP2B6, el CYP2C8, el CYP2C9, y puede inducir el CYP2C19 y las UGTs. Por lo tanto, puede disminuir la exposición sistémica a los sustratos de estas enzimas (ver secciones 4.4, 4.5 y 4.6).
Ivosidenib inhibe la P-gp in vitro y tiene el potencial de inducir la P-gp. Por lo tanto, puede alterar la exposición sistémica a sustancias activas que son transportadas predominantemente por la P-gp (ver secciones 4.3 y 4.5).
Los datos in vitro sugieren que ivosidenib tiene el potencial de inhibir la OAT3, la OATP1B1 y la OATP1B3 a concentraciones clínicamente relevantes y puede, por tanto, aumentar la exposición sistémica a los sustratos de la OAT3, la OATP1B1 o la OATP1B3 (ver sección 4.5).
Eliminación
En pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib y azacitidina, el aclaramiento aparente medio de ivosidenib en el estado estacionario fue de 4,6 l/hora (35%) con una semivida terminal media de 98 horas (42%).
En pacientes con colangiocarcinoma, el aclaramiento aparente medio de ivosidenib en el estado estacionario fue de 6,1 l/hora (31%) con una semivida terminal media de 129 horas (102%).
En individuos sanos, el 77% de una dosis oral única de ivosidenib se encontró en las heces, recuperándose el 67% inalterado. Aproximadamente el 17% de una dosis oral única se encontró en la orina, recuperándose el 10% inalterado.
Linealidad/No linealidad
El AUC y la Cmax de ivosidenib aumentaron de forma menor que proporcional a la dosis de 200 mg a
1 200 mg una vez al día (0,4 a 2,4 veces la dosis recomendada).
Poblaciones especiales
Edad avanzada
No se observaron efectos clínicamente significativos en la farmacocinética de ivosidenib en pacientes de hasta 84 años. Se desconoce la farmacocinética de ivosidenib en pacientes de 85 años de edad o mayores (ver sección 4.2).
Insuficiencia renal
No se observaron efectos clínicamente significativos en la farmacocinética de ivosidenib en pacientes con insuficiencia renal leve o moderada (TFGe ≥ 30 ml/min/1,73 m2). Se desconoce la farmacocinética de ivosidenib en pacientes con insuficiencia renal grave (TFGe < 30 ml/min/1,73 m2) o con insuficiencia renal que requiere diálisis (ver sección 4.2).
Insuficiencia hepática
Utilizando la clasificación del NCI, no se observaron efectos clínicamente significativos en la farmacocinética de ivosidenib en pacientes con insuficiencia hepática leve. La farmacocinética de ivosidenib en pacientes con insuficiencia hepática moderada y grave se desconoce en pacientes con LMA de nuevo dianóstico o con colangiocarcinoma (ver sección 4.2). No se dispone de datos de PK en pacientes con insuficiencia hepática estratificada según la clasificación de Child-Pugh.
Otros
No se observaron efectos clínicamente significativos en la farmacocinética de ivosidenib en función del sexo, la raza, el peso corporal o el estado funcional ECOG.
5.3 Datos preclínicos sobre seguridad
Farmacología de seguridad
El potencial de ivosidenib para la prolongación del intervalo QT se puso de manifiesto en estudios preclínicos in vitro e in vivo a niveles plasmáticos clínicamente relevantes.
Toxicidad a dosis repetidas
En estudios en animales con exposiciones clínicamente relevantes, ivosidenib indujo anomalías hematológicas (hipocelularidad de la médula ósea, depleción linfocítica, disminución de la masa de glóbulos rojos junto con hematopoyesis extramedular en el bazo), toxicidad gastrointestinal, hallazgos tiroideos (hipertrofia/hiperplasia de células foliculares en ratas), toxicidad hepática (transaminasas elevadas, aumento de peso, hipertrofia hepatocelular y necrosis en ratas e hipertrofia hepatocelular asociada a un aumento de peso del hígado en monos) y hallazgos renales (vacuolación tubular y necrosis en ratas). Los efectos tóxicos observados en el sistema hematológico, sistema gastrointestinal y riñón fueron reversibles, mientras que los efectos tóxicos en hígado, bazo y tiroides se seguían observando tras el periodo de recuperación.
Genotoxicidad y carcinogenicidad
Ivosidenib no fue mutagénico ni clastogénico en ensayos convencionales de genotoxicidad in vitro e in vivo. No se han realizado estudios de carcinogenicidad con ivosidenib.
Toxicidad para la reproducción y el desarrollo
No se han realizado estudios de fertilidad con ivosidenib. En el estudio de toxicidad a dosis repetidas de 28 días en ratas, se observó atrofia uterina en las hembras a niveles de dosis no tolerados de aproximadamente 1,7 veces la exposición clínica (en base al AUC) y fue reversible después de un período de recuperación de 14 días. En los machos se observó degeneración testicular a niveles de dosis no tolerados de aproximadamente 1,2 veces la exposición clínica (en base al AUC) en animales sometidos a eutanasia prematura.
En estudios de desarrollo embriofetal en ratas, se observó un menor peso corporal del feto y un retraso en la osificación del esqueleto en ausencia de toxicidad materna. En conejos, se observó toxicidad materna, abortos espontáneos, disminución del peso corporal del feto, aumento de la pérdida post implantación, retraso en la osificación del esqueleto y variación del desarrollo visceral (bazo
pequeño). Los estudios en animales indican que ivosidenib atraviesa la placenta y se encuentra en el plasma fetal. En ratas y conejos, los niveles sin efectos adversos observados para el desarrollo embriofetal fueron 0,4 veces y 1,4 veces la exposición clínica (en base al AUC), respectivamente.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Núcleo del comprimido
Celulosa microcristalina
Croscarmelosa sódica
Succinato acetato de hipromelosa
Sílice coloidal anhidra Estearato de magnesio Laurilsulfato de sodio (E487)
Película de recubrimiento
Hipromelosa
Dióxido de titanio (E171) Lactosa monohidrato Triacetina
Laca de aluminio carmín de índigo (E132)
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
5 años.
6.4 Precauciones especiales de conservación
Este medicamento no requiere ninguna temperatura especial de conservación. Mantener el frasco perfectamente cerrado para protegerlo de la humedad.
6.5 Naturaleza y contenido del envase
Frasco de polietileno de alta densidad (HDPE) con cierre de polipropileno (PP) a prueba de niños y revestimiento de polietileno (PE) termosellado por inducción. Cada frasco contiene 60 comprimidos recubiertos con película y un desecante de gel de sílice en el envase de HDPE.
6.6 Precauciones especiales de eliminación
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
Francia
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/23/1728/001
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 04 mayo 2023
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu, y en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/)
ANEXO II
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Les Laboratoires Servier Industrie
905, route de Saran
45520 Gidy
Francia
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las
Características del Producto, sección 4.2)
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Informes periódicos de seguridad (IPSs)
Los requerimientos para la presentación de los IPSs para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado
7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
El titular de la autorización de comercialización (TAC) presentará el primer IPS para este medicamento en un plazo de 6 meses después de la autorización.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
Plan de gestión de riesgos (PGR)
El titular de la autorización de comercialización (TAC) realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo
1.8.2 de la autorización de comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
A petición de la Agencia Europea de Medicamentos.
Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
Medidas adicionales de minimización de riesgos
Antes del lanzamiento de Tibsovo en cada Estado Miembro, el titular de la autorización de comercialización (TAC) debe acordar con la Autoridad Nacional Competente el contenido y el formato del programa informativo de seguridad, incluyendo los medios de comunicación, las modalidades de distribución y cualquier otro aspecto del programa.
El programa informativo de seguridad está dirigido a pacientes con LMA a los que se les ha prescrito Tibsovo, para proporcionar más información sobre el importante riesgo identificado del síndrome de diferenciación.
El TAC se asegurará de que en cada Estado Miembro donde se comercialice Tibsovo, todos los pacientes que se espera que utilicen Tibsovo reciban el siguiente material informativo de seguridad:
Material de información para el paciente:
Prospecto.
Tarjeta de información para el paciente:
o Información para pacientes con LMA de que el tratamiento con Tibsovo puede causar síndrome de diferenciación.
o Descripción de los signos o síntomas del problema de seguridad y cuándo buscar atención médica si se sospecha de síndrome de diferenciación.
o Un mensaje de advertencia para los profesionales sanitarios que tratan al paciente en cualquier momento, incluso en situaciones de emergencia, indicando que el paciente está utilizando Tibsovo.
o Datos de contacto del médico que ha prescrito Tibsovo.
o Necesidad de llevarla en todo momento y presentarla a cualquier profesional sanitario.
La tarjeta de información para el paciente se incluirá en el embalaje y el contenido será acordado como parte del etiquetado (Anexo III).
ANEXO III ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
CAJA EXTERIOR

1. NOMBRE DEL MEDICAMENTO
![]()
![]()
Tibsovo 250 mg comprimidos recubiertos con película ivosidenib
2. PRINCIPIO(S) ACTIVO(S)
![]()
Cada comprimido recubierto con película contiene 250 mg de ivosidenib.
3. LISTA DE EXCIPIENTES
![]()
Contiene lactosa. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Comprimido recubierto con película
![]()
60 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
![]()
Leer el prospecto antes de utilizar este medicamento. Vía oral.
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
![]()
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
![]()
No tragar el desecante.
8. FECHA DE CADUCIDAD
![]()
EXP
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Mantener el frasco perfectamente cerrado para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA

11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
![]()
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
![]()
Francia
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
![]()
EU/1/23/1728/001
13. NÚMERO DE LOTE
![]()
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
![]()
15. INSTRUCCIONES DE USO
![]()
16. INFORMACIÓN EN BRAILLE
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
![]()
![]()
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC SN NN
INFORMACIÓN MÍNIMA A INCLUIR EN EL ACONDICIONAMIENTO PRIMARIO
FRASCO

1. NOMBRE DEL MEDICAMENTO
![]()
![]()
Tibsovo 250 mg comprimidos recubiertos con película ivosidenib
2. PRINCIPIO(S) ACTIVO(S)
![]()
Cada comprimido recubierto con película contiene 250 mg de ivosidenib.
3. LISTA DE EXCIPIENTES
![]()
Contiene lactosa. Para mayor información consultar el prospecto.
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
Comprimido
![]()
60 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
![]()
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
![]()
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
![]()
No tragar el desecante
8. FECHA DE CADUCIDAD
![]()
EXP
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
Mantener el frasco perfectamente cerrado para protegerlo de la humedad.
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA

11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
![]()
![]()
Les Laboratoires Servier
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
![]()
EU/1/23/1728/001
13. NÚMERO DE LOTE
![]()
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
![]()
16. INFORMACIÓN EN BRAILLE
![]()
![]()
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
![]()
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
CONTENIDO DE LA TARJETA DE INFOMARCIÓN PARA EL PACIENTE
![]()
TARJETA DE INFORMACIÓN PARA EL PACIENTE – LEUCEMIA MIELOIDE AGUDA
Tibsovo 250 mg comprimidos recubiertos con película ivosidenib
Información para el paciente tratado de leucemia mieloide aguda
Esta tarjeta de información para el paciente contiene información importante para usted y para los profesionales sanitarios sobre Tibsovo.
Lleve esta tarjeta siempre con usted.
Informe a cualquier médico, farmacéutico o enfermero de que está tomando Tibsovo.
Contacte inmediatamente con un profesional sanitario y muestre la tarjeta de información para el paciente si presenta alguno de los síntomas que se enumeran a continuación.
Asegúrese de utilizar la última versión de esta tarjeta. Esta será la que se encuentra en su última caja de comprimidos.
Acerca de su tratamiento
Tibsovo se utiliza para tratar a adultos con leucemia mieloide aguda (LMA) y se administra en combinación con otro medicamento contra el cáncer llamado 'azacitidina'. Tibsovo sólo se utiliza en pacientes cuya LMA está relacionada con un cambio (mutación) en la proteína IDH1.
Tibsovo puede causar efectos adversos graves, incluido un trastorno grave conocido como
síndrome de diferenciación.
El síndrome de diferenciación puede ser potencialmente mortal si no se trata.
El síndrome de diferenciación en pacientes con LMA ocurrió hasta 46 días después de iniciar el tratamiento.
Busque atención médica urgente si presenta alguno de los siguientes síntomas del síndrome de diferenciación:
fiebre
tos
dificultad para respirar
erupción cutánea
disminución de la orina
mareo o vahído
aumento rápido de peso
hinchazón de brazos o piernas
Para más información, consulte el Prospecto de Tibsovo.
Información para los profesionales sanitarios
Pacientes tratados con Tibsovo han experimentado el síndrome de diferenciación, que puede poner en riesgo la vida o ser mortal si no se trata.
El síndrome de diferenciación en pacientes con LMA ocurrió hasta 46 días después de iniciar el tratamiento.
El síndrome de diferenciación se asocia a una rápida proliferación y diferenciación de las células mieloides.
Los síntomas incluyen:
Leucocitosis no infecciosa, edema periférico, pirexia, disnea, derrame pleural, hipotensión, hipoxia, edema pulmonar, neumonitis, derrame pericárdico, erupción cutánea, sobrecarga de líquidos, síndrome de lisis tumoral y aumento de la creatinina.
Si se sospecha de síndrome de diferenciación, administrar corticosteroides sistémicos e iniciar monitorización hemodinámica hasta la resolución de los síntomas y durante un mínimo de 3 días.
Para más información, consulte la Ficha Técnica de Tibsovo. Por favor complete esta sección
Nombre del paciente: Fecha de nacimiento: Fecha de inicio de Tibsovo y dosis: Médico prescriptor/Contacto de emergencia del hospital:
B. PROSPECTO
Prospecto: información para el paciente
Tibsovo 250 mg comprimidos recubiertos con película
ivosidenib
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es Tibsovo y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar Tibsovo
3. Cómo tomar Tibsovo
4. Posibles efectos adversos
5. Conservación de Tibsovo
6. Contenido del envase e información adicional
 1. Qué es Tibsovo y para qué se utiliza
1. Qué es Tibsovo y para qué se utiliza
Qué es Tibsovo
Tibsovo contiene el principio activo ivosidenib. Es un medicamento utilizado para tratar determinados tipos de cáncer que incluyen un gen mutado (alterado) que produce una proteína conocida como IDH1, la cual desempeña un papel importante en la producción de energía para las células. Cuando la enzima IDH1 está mutada, los cambios metabólicos en la célula pueden conducir al desarrollo del cáncer. Tibsovo bloquea la forma mutada de la proteína IDH1 y ayuda a ralentizar o detener el crecimiento del cáncer.
Para qué se utiliza Tibsovo
Tibsovo se utiliza para tratar adultos con:
leucemia mieloide aguda (LMA). Cuando se utilice en pacientes con LMA, Tibsovo se administrará en combinación con otro medicamento contra el cáncer denominado "azacitidina".
cáncer de vías biliares (también conocido como "colangiocarcinoma"). Tibsovo se utiliza en monoterapia para tratar a los pacientes cuyo cáncer de vías biliares se ha diseminado a otras partes del cuerpo y que han recibido, al menos, un tratamiento previo.
Tibsovo sólo se utiliza en pacientes con LMA o cáncer de vías biliares que estén relacionados con un cambio (mutación) en la proteína IDH1.
 2. Qué necesita saber antes de empezar a tomar Tibsovo
2. Qué necesita saber antes de empezar a tomar Tibsovo
Su médico le hará una prueba para comprobar si tiene una mutación en la proteína IDH1 antes de decidir si este medicamento es el tratamiento adecuado para usted.
No tome Tibsovo
si es alérgico a ivosidenib o a alguno de los demás componentes de este medicamento
(incluidos en la sección 6);
si ya está tomando medicamentos como dabigatrán (un medicamento utilizado para prevenir la formación de coágulos sanguíneos), Hierba de San Juan (un remedio a base de plantas utilizado para la depresión y la ansiedad), rifampicina (un medicamento utilizado para tratar infecciones bacterianas) o ciertos medicamentos utilizados para tratar la epilepsia (por ejemplo, carbamazepina, fenobarbital, fenitoína).
si tiene un problema cardíaco de nacimiento llamado "síndrome de QTc largo congénito".
si tiene antecedentes familiares de muerte súbita o latidos anormales o irregulares en las cavidades inferiores del corazón.
si tiene una anomalía grave de la conducción eléctrica del corazón que afecta a su ritmo, denominada "prolongación del intervalo QTc".
No tome Tibsovo si algo de lo anterior le aplica a usted. Si no está seguro, hable con su médico o enfermero.

Advertencias y precauciones
Síndrome de diferenciación en pacientes con LMA
Tibsovo puede causar una afección grave conocida como síndrome de diferenciación en pacientes con LMA. Esta es una condición que afecta a sus células sanguíneas y puede resultar potencialmente mortal si no se trata.
Busque atención médica urgente si tiene alguno de los siguientes síntomas después de tomar Tibsovo:
fiebre,
tos,
dificultad para respirar,
erupción cutánea,
disminución de la orina,
mareo o vahído,
aumento rápido de peso,
hinchazón de brazos o piernas.
Estos pueden ser signos del síndrome de diferenciación.
El embalaje contiene una tarjeta de información para el paciente para llevar siempre consigo. Incluye información importante para usted y sus profesionales sanitarios sobre qué hacer si presenta alguno de los síntomas del síndrome de diferenciación (ver sección 4).
Prolongación del intervalo QTc:
Tibsovo puede causar una afección grave conocida como prolongación del intervalo QTc, que puede provocar latidos irregulares y arritmias potencialmente mortales (actividad eléctrica anormal del corazón que afecta a su ritmo). Su médico debe comprobar el sistema de
conducción eléctrica de su corazón antes y durante el tratamiento con Tibsovo (ver 'Pruebas periódicas').
Busque atención médica urgente si sufre mareo, vahídos, palpitaciones o desfallecimiento (ver también la sección 4) después de tomar Tibsovo.
Durante el tratamiento, informe a sus médicos de que está tomando Tibsovo antes de empezar a tomar cualquier medicamento nuevo, ya que puede aumentar el riesgo de un ritmo cardíaco
anormal.
Si tiene alguno de los efectos adversos graves mencionados arriba, su médico puede darle otros medicamentos para tratarlos y puede decirle que deje el tratamiento con Tibsovo durante un tiempo o que lo deje completamente.
Hable con su médico antes de tomar Tibsovo si:
tiene problemas cardíacos o tiene problemas de niveles anormales de electrolitos (como el sodio, potasio, calcio o magnesio);
está tomando ciertos medicamentos que pueden afectar al corazón (por ejemplo, los utilizados para prevenir la arritmia, llamados antiarrítmicos, algunos antibióticos, algunos antifúngicos y los utilizados para prevenir las náuseas y los vómitos, ver "Otros medicamentos y Tibsovo");
tiene problemas de riñón;
tiene problemas de hígado.
Pruebas periódicas
Su médico le hará un seguimiento estrecho antes y durante el tratamiento con Tibsovo. Tendrá que someterse a electrocardiogramas periódicos (ECG; un registro de la actividad eléctrica de su corazón) para controlar su ritmo cardíaco. Se le hará un ECG antes de empezar el tratamiento con Tibsovo, una vez a la semana durante las primeras tres semanas de tratamiento, y después mensualmente. Se pueden realizar ECG adicionales según las indicaciones de su médico. Si empieza a tomar ciertos medicamentos que pueden afectar a su corazón, se le hará un ECG antes de empezar y durante el
tratamiento con el nuevo medicamento, según sea necesario.
También se le hará un análisis de sangre antes de comenzar el tratamiento con Tibsovo y posteriormente con regularidad.
Si es necesario, su médico puede reducir su dosis de Tibsovo, interrumpirla temporalmente o suspenderla por completo.
Niños y adolescentes
No administrar este medicamento a niños y adolescentes menores de 18 años porque no hay información sobre su uso en este grupo de edad.
Otros medicamentos y Tibsovo
Informe a su médico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento. Esto se debe a que pueden reducir la eficacia de Tibsovo o aumentar el riesgo de efectos adversos, o Tibsovo puede afectar a la forma en que funcionan estos otros medicamentos.
En particular, debe informar a su médico si está tomando alguno de los siguientes medicamentos para que pueda decidir si es necesario cambiar su tratamiento:
antibióticos utilizados para infecciones bacterianas (por ejemplo, eritromicina, claritromicina, bencilpenicilina, ciprofloxacino, levofloxacino);
warfarina (utilizada para prevenir los coágulos de sangre);
medicamentos utilizados para las infecciones fúngicas (por ejemplo, itraconazol, ketoconazol, fluconazol, isavuconazol, posaconazol, voriconazol);
medicamentos que afectan a los latidos del corazón conocidos como antiarrítmicos (por ejemplo, diltiazem, verapamilo, quinidina);
medicamentos utilizados para detener las náuseas y los vómitos, conocidos como antieméticos (por ejemplo, aprepitant, ondansetrón, tropisetrón, granisetrón);
medicamentos utilizados después de los trasplantes de órganos conocidos como inmunosupresores (por ejemplo, ciclosporina, everólimus, sirólimus, tacrólimus);
medicamentos utilizados para el VIH (por ejemplo, raltegravir, ritonavir);
alfentanilo (utilizado para la anestesia en la cirugía);
fentanilo (utilizado para el dolor intenso);
pimozida (utilizada para la esquizofrenia);
medicamentos utilizados para el cáncer (por ejemplo, ciclofosfamida, ifosfamida, paclitaxel);
metadona (utilizada para la adicción a la morfina o a la heroína, o para el dolor intenso);
medicamentos utilizados para la diabetes tipo 2 (por ejemplo, pioglitazona, repaglinida);
omeprazol (utilizado para las úlceras de estómago y el reflujo ácido);
furosemida (utilizada para la acumulación de líquidos conocida como edema);
medicamentos utilizados para el colesterol alto conocidos como estatinas (por ejemplo, atorvastatina, pravastatina, rosuvastatina).
lamotrigina (utilizada para la epilepsia).
Toma de Tibsovo con alimentos y bebidas
No tome pomelo o zumo de pomelo durante el tratamiento con Tibsovo ya que puede afectar al funcionamiento de este medicamento.
Embarazo, lactancia y fertilidad
No se recomienda el uso de Tibsovo durante el embarazo, ya que puede dañar al feto. Las mujeres en edad fértil se deben hacer una prueba de embarazo antes de iniciar el tratamiento con Tibsovo y deben evitar quedarse embarazadas durante el tratamiento.
Si está embarazada, cree que podría estarlo o tiene intención de quedarse embarazada, consulte a su médico antes de tomar este medicamento. Contacte con su médico o enfermero inmediatamente si se queda embarazada mientras toma Tibsovo.
Anticoncepción
Tibsovo no se debe utilizar durante el embarazo ya que puede dañar al feto. Las mujeres que puedan quedarse embarazadas o los hombres con parejas que puedan quedarse embarazadas deben utilizar métodos anticonceptivos eficaces para evitar el embarazo durante el tratamiento con Tibsovo y durante, al menos, 1 mes después de la última dosis.
Tibsovo puede impedir que los anticonceptivos hormonales funcionen correctamente. Si usted o su pareja utilizan un anticonceptivo hormonal (por ejemplo, píldoras anticonceptivas, o parches o implantes anticonceptivos), deben utilizar también un método de barrera (por ejemplo, preservativos o un diafragma) para evitar el embarazo. Consulte con su médico o enfermero sobre el método anticonceptivo adecuado para usted.
Lactancia
Se desconoce si Tibsovo pasa a la leche materna. No dé el pecho a su bebé durante el tratamiento con
Tibsovo y durante, al menos, 1 mes después de la última dosis.
Fertilidad
Se desconoce si Tibsovo afecta a la fertilidad. Si le preocupa su fertilidad mientras toma Tibsovo, hable con su médico.
Conducción y uso de máquinas
Este medicamento tiene una influencia pequeña sobre su capacidad para conducir o utilizar cualquier herramienta o máquina. Si se siente mal después de tomar Tibsovo, no conduzca ni utilice herramientas o máquinas hasta que se sienta bien de nuevo.
Tibsovo contiene lactosa y sodio
Si su médico le ha indicado que padece una intolerancia a ciertos azúcares, consulte con él antes de tomar este medicamento.
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por comprimido; esto es, esencialmente “exento de sodio”.
 3. Cómo tomar Tibsovo
3. Cómo tomar Tibsovo
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o enfermero.
La dosis recomendada es de 2 comprimidos (500 mg de ivosidenib) que deben tomarse una vez al día aproximadamente a la misma hora cada día.
Su médico puede indicarle que tome 1 comprimido (250 mg de ivosidenib) si está tomando otros medicamentos o para ayudarle a tolerar mejor algunos posibles efectos adversos.
Tome los comprimidos sin alimentos. No coma nada durante 2 horas antes y 1 hora después
de tomar los comprimidos.
Trague los comprimidos enteros con agua.
No tragar el desecante que se encuentra en el frasco. El desecante ayuda a proteger a los comprimidos de la humedad (ver sección 5 y sección 6).
Si vomita después de tomar su dosis habitual, no tome comprimidos adicionales. Tome su siguiente dosis como de costumbre al día siguiente.
Si toma más Tibsovo del que debe
Si accidentalmente toma más comprimidos de los que le ha recetado su médico, busque atención médica urgente y lleve el frasco del medicamento con usted.
Si olvidó tomar Tibsovo
Si olvida una dosis o no la toma a la hora habitual, tome los comprimidos lo antes posible, a menos que la siguiente dosis deba tomarse en las siguientes 12 horas. No tome dos dosis en 12 horas. Tome la siguiente dosis como de costumbre al día siguiente.
Cuánto tiempo debe tomar Tibsovo
Debe seguir tomando este medicamento hasta que su médico le indique que lo interrumpa. No deje de tomar los comprimidos sin antes consultarlo con su médico.
Si tiene alguna otra duda sobre el uso de este medicamento, pregunte a su médico o enfermero.
 4. Posibles efectos adversos
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Busque atención médica urgente si sufre alguno de los siguientes efectos adversos. Los síntomas enumerados a continuación podrían deberse a afecciones graves conocidas como síndrome de diferenciación o prolongación del intervalo QTc, ambas potencialmente mortales:
- Síndrome de diferenciación
Contacte con su médico inmediatamente si presenta alguno de los siguientes síntomas:
fiebre,
tos,
dificultad para respirar,
erupción cutánea,
disminución de la orina,
mareo o vahído,
aumento rápido de peso,
hinchazón de brazos o piernas.
Algunos o todos de estos síntomas pueden ser signos de una afección denominada síndrome de diferenciación (puede afectar a más de 1 de cada 10 personas).
El síndrome de diferenciación en pacientes con LMA ocurrió hasta 46 días después de empezar
Tibsovo.

- Problemas del ritmo cardíaco (prolongación del intervalo QTc)
Póngase en contacto con su médico inmediatamente si experimenta un cambio en los latidos de su corazón, o si se siente: mareado, aturdido o débil. Estos pueden ser signos de un problema cardíaco llamado prolongación del intervalo QT (puede afectar a más de 1 de cada 10 personas).
Otros efectos adversos
Informe a su médico si nota alguno de los siguientes efectos adversos:
Para pacientes con LMA
Muy frecuentes (puede afectar a más de 1 de cada 10 personas):
vómitos;
neutropenia (niveles bajos de neutrófilos, un tipo de glóbulo blanco que combate las infecciones);
trombocitopenia (niveles bajos de plaquetas en sangre que pueden provocar hemorragias y hematomas);
leucocitosis (niveles elevados de glóbulos blancos);
insomnio (dificultad para dormir);
dolor en las extremidades, dolor de articulaciones;
dolor de cabeza;
mareo;
dolor de espalda.
Frecuentes (puede afectar a más de 1 de cada 100 personas):
dolor en la boca o en la garganta;
neuropatía periférica (lesiones en nervios de brazos y piernas que causan dolor o entumecimiento, sensación de ardor u hormigueo);
leucopenia (niveles bajos de glóbulos blancos).
Para pacientes con cáncer de vías biliares
Muy frecuentes (puede afectar a más de 1 de cada 10 personas):
fatiga;
náuseas;
dolor abdominal;
diarrea;
disminución del apetito;
ascitis (acumulación de líquido en el abdomen);
vómitos;
anemia (niveles bajos de glóbulos rojos);
dolor de cabeza;
cambios en las pruebas de función hepática (Aspartato aminotransferasa aumentada);
neuropatía periférica (lesiones en nervios de brazos y piernas que causan dolor o entumecimiento, sensación de ardor u hormigueo);
erupción cutánea;
aumento de la bilirrubina en sangre (un producto de descomposición de los glóbulos rojos) que puede causar coloración amarillenta de la piel y los ojos.
Frecuentes (puede afectar a más de 1 de cada 100 personas):
disminución del recuento de glóbulos blancos;
disminución del recuento de plaquetas;
cambios en las pruebas de función hepática (Alanina aminotransferasa aumentada);
caída;
hiperbilirrubinemia (niveles altos de bilirrubina en sangre);
ictericia colestática (acumulación de bilis que provoca coloración amarillenta de la piel o los ojos).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
 5. Conservación de Tibsovo
5. Conservación de Tibsovo
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta del frasco y en la caja después de EXP. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere ninguna temperatura especial de conservación. Mantener el frasco perfectamente cerrado para protegerlo de la humedad. Mantener el desecante dentro del frasco (ver sección 6).
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
 6. Contenido del envase e información adicional
6. Contenido del envase e información adicional
Composición de Tibsovo
El principio activo es ivosidenib. Cada comprimido contiene 250 miligramos de ivosidenib.
Los demás componentes son celulosa microcristalina, croscarmelosa sódica, succinato acetato de hipromelosa, sílice coloidal anhidra, estearato de magnesio, laurilsulfato de sodio (E487), hipromelosa, dióxido de titanio (E171), lactosa monohidrato, triacetina y laca de aluminio carmín de índigo (E132) (ver sección 2 "Tibsovo contiene lactosa y sodio").
Aspecto del producto y contenido del envase
Los comprimidos recubiertos con película son de color azul, ovalados, grabados con "IVO" en una cara y "250" en la otra.
Tibsovo se presenta en frascos de plástico que contienen 60 comprimidos recubiertos con película y un desecante. Los frascos se presentan en una caja de cartón; cada caja contiene
1 frasco.
Titular de la autorización de comercialización
Les Laboratoires Servier
50 rue Carnot
92284 Suresnes Cedex
Francia
Responsable de la fabricación
Les Laboratoires Servier Industrie
905, route de Saran
45520 Gidy
Francia
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien S.A. Servier Benelux N.V. Tel: +32 (0)2 529 43 11
Lietuva
UAB “SERVIER PHARMA” Tel: +370 (5) 2 63 86 28
България
Сервие Медикал ЕООД Тел.: +359 2 921 57 00
Luxembourg/Luxemburg S.A. Servier Benelux N.V. Tel: +32 (0)2 529 43 11
Česká republika
Servier s.r.o.
Tel: +420 222 118 111
Magyarország Servier Hungaria Kft. Tel: +36 1 238 7799
Danmark
Servier Danmark A/S Tlf: +45 36 44 22 60
Malta
V.J. Salomone Pharma Ltd
Tel: + 356 21 22 01 74
Deutschland
Servier Deutschland GmbH Tel: +49 (0)89 57095 01
Nederland
Servier Nederland Farma B.V. Tel: +31 (0)71 5246700
Eesti
Servier Laboratories OÜ Tel:+ 372 664 5040
Norge
Servier Danmark A/S Tlf: +45 36 44 22 60
Eλλάδα
ΣΕΡΒΙΕ ΕΛΛΑΣ ΦΑΡΜΑΚΕΥΤΙΚΗ ΕΠΕ Τηλ: +30 210 939 1000
Österreich
Servier Austria GmbH Tel: +43 (1) 524 39 99
España
Laboratorios Servier S.L. Tel: +34 91 748 96 30
Polska
Servier Polska Sp. z o.o. Tel: +48 (0) 22 594 90 00
France
Les Laboratoires Servier
Tel: +33 (0)1 55 72 60 00
Portugal
Servier Portugal, Lda
Tel.: +351 21 312 20 00
Hrvatska
Servier Pharma, d. o. o. Tel.: +385 (0)1 3016 222
România
Servier Pharma SRL Tel: +4 021 528 52 80
Ireland
Servier Laboratories (Ireland) Ltd. Tel: +353 (0)1 663 8110
Slovenija
Servier Pharma d. o. o. Tel.: +386 (0)1 563 48 11
Ísland
Servier Laboratories c/o Icepharma hf Sími: +354 540 8000
Slovenská republika
Servier Slovensko spol. s r.o. Tel.:+421 (0) 2 5920 41 11
Italia
Servier Italia S.p.A. Tel: +39 06 669081
Suomi/Finland
Servier Finland Oy
P. /Tel: +358 (0)9 279 80 80
Κύπρος
C.A. Papaellinas Ltd. Τηλ: +357 22741741
Sverige
Servier Sverige AB
Tel : +46 (0)8 522 508 00
Latvija
SIA Servier Latvia
Tel: +371 67502039
Fecha de la última revisión de este prospecto: Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu , y en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/)
Este prospecto está disponible en todos los idiomas de la UE/EEE en la página web de la Agencia
Europea de Medicamentos.

