 VANFLYTA 26,5 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
VANFLYTA 26,5 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
| ATC: Quizartinib |
| PA: Quizartinib dihidrocloruro |
Envases
 Introducción
Introducción
ANEXO I
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
1. NOMBRE DEL MEDICAMENTO
VANFLYTA 17,7 mg comprimidos recubiertos con película
VANFLYTA 26,5 mg comprimidos recubiertos con película
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
VANFLYTA 17,7 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 17,7 mg de quizartinib (como dihidrocloruro).
VANFLYTA 26,5 mg comprimidos recubiertos con película
Cada comprimido recubierto con película contiene 26,5 mg de quizartinib (como dihidrocloruro). Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimido recubierto con película (comprimido) VANFLYTA 17,7 mg comprimidos recubiertos con película
Comprimidos recubiertos con película de color blanco, redondos, de 8,9 mm de diámetro y con la inscripción “DSC 511” en una cara.
VANFLYTA 26,5 mg comprimidos recubiertos con película
Comprimidos recubiertos con película de color amarillo, redondos, de 10,2 mm de diámetro y con la inscripción “DSC 512” en una cara.
4. DATOS CLÍNICOS
4.1 Indicaciones terapéuticas
VANFLYTA está indicado, en combinación con quimioterapia estándar de inducción con citarabina y antraciclina y con quimioterapia estándar de consolidación con citarabina, seguido de terapia de mantenimiento con VANFLYTA en monoterapia, para pacientes adultos con leucemia mieloide aguda (LMA) de nuevo diagnóstico que sea FLT3-ITD positiva.
4.2 Posología y forma de administración
El tratamiento con VANFLYTA lo debe iniciar un médico con experiencia en el uso de tratamientos oncológicos.
Antes de tomar VANFLYTA, los pacientes con LMA deben tener confirmación de LMA FLT3-ITD positiva mediante un producto sanitario de diagnóstico in vitro (DIV) con marcado CE para la finalidad prevista correspondiente. Si no se dispone de un DIV con marcado CE, se debe evaluar la confirmación de la LMA FLT3-ITD positiva mediante una prueba validada alternativa.
Se deben realizar ECG y corregir las anomalías en los electrolitos antes de comenzar el tratamiento
(ver sección 4.4).
Posología
VANFLYTA se debe administrar en combinación con quimioterapia estándar a una dosis de 35,4 mg (2 × 17,7 mg) una vez al día durante dos semanas en cada ciclo de inducción. Para los pacientes que alcancen remisión completa (RC) o remisión completa con recuperación hematológica incompleta (RCi), VANFLYTA se debe administrar a una dosis de 35,4 mg una vez al día durante dos semanas en cada ciclo de quimioterapia de consolidación, seguido de una terapia de mantenimiento con VANFLYTA en monoterapia que se iniciará a una dosis de 26,5 mg una vez al día. Después de dos semanas, la dosis de mantenimiento se debe aumentar a 53 mg (2 × 26,5 mg) una vez al día si el intervalo QT corregido mediante la fórmula de Fridericia (QTcF) es ≤450 ms (ver la Tabla 2 y la sección 4.4). La terapia de mantenimiento en monoterapia se puede continuar durante un máximo de
36 ciclos.
Para obtener información adicional sobre la administración, ver las Tablas 1 a 3.
Tabla 1: Esquema posológico
| Iniciación de VANFLYTA | Induccióna | Consolidaciónb | Mantenimiento |
| Iniciación de VANFLYTA | A partir del día 8 (Para el esquema 7 + 3)c | A partir del día 6 | Primer día de terapia de mantenimiento |
| Dosis | 35,4 mg una vez al día. | 35,4 mg una vez al día. | • Dosis inicial de 26,5 mg una vez al día durante dos semanas si el QTcF es ≤450 ms. • Tras dos semanas, si el QTcF es ≤450 ms, la dosis se debe incrementar a 53 mg una vez al día. |
| Duración (ciclos de 28 días) | Dos semanas en cada ciclo | Dos semanas en cada ciclo | Una vez al día sin descanso entre ciclos durante un máximo de 36 ciclos. |
a Los pacientes pueden recibir un máximo de 2 ciclos de inducción.
b Los pacientes pueden recibir un máximo de 4 ciclos de consolidación.
c Para el esquema 5 + 2 como segundo ciclo de inducción, se iniciará VANFLYTA el día 6.
Trasplante de células madre hematopoyéticas
En pacientes que se van a someter a un trasplante de células madre hematopoyéticas (TCMH), se debe interrumpir VANFLYTA 7 días antes de comenzar un esquema de acondicionamiento. Se puede reanudar después de realizar el trasplante en función del recuento de leucocitos y a discreción del médico a cargo en los pacientes con una recuperación hematológica suficiente y con enfermedad de injerto contra huésped (EICH) de grado ≤2 que no requieren iniciar un nuevo tratamiento sistémico para la EICH en un plazo de 21 días, siguiendo las recomendaciones posológicas descritas anteriormente.
Modificaciones posológicas
Únicamente se debe iniciar el tratamiento con VANFLYTA si el QTcF es ≤450 ms (ver sección 4.4).
Para las modificaciones posológicas recomendadas debidas a las reacciones adversas, ver la Tabla 2. Para los ajustes de dosis debidos a las reacciones adversas y/o al uso concomitante con inhibidores potentes de CYP3A, ver la Tabla 3.
Tabla 2: Modificaciones posológicas recomendadas por reacciones adversas
| Reacción adversa | Acción recomendada |
| QTcF 450-480 ms (grado 1) | • Continuar con la dosis de VANFLYTA. |
| QTcF 481-500 ms (grado 2) | • Reducir la dosis de VANFLYTA (ver la Tabla 3) sin interrumpir. • Reanudar VANFLYTA a la dosis previa en el siguiente ciclo si el QTcF ha disminuido a <450 ms. Vigilar estrechamente al paciente por si se produce prolongación del QT durante el primer ciclo a la dosis aumentada. |
| QTcF ≥501 ms (grado 3) | • Interrumpir VANFLYTA. • Reanudar VANFLYTA a una dosis reducida (ver la Tabla 3) cuando el QTcF vuelva a <450 ms. • No aumentar a 53 mg una vez al día durante el mantenimiento si se observó un QTcF >500 ms durante la inducción y/o la consolidación, y se sospecha que está asociado a VANFLYTA. Mantener la dosis de 26,5 mg una vez al día. |
| QTcF ≥501 ms de forma recurrente (grado 3) | • Suspender VANFLYTA de forma permanente si el QTcF >500 ms reaparece a pesar de una reducción adecuada de la dosis y de la corrección/eliminación de otros factores de riesgo (p. ej., anomalías electrolíticas séricas, medicamentos concomitantes que prolongan el QT). |
| Torsade de pointes; taquicardia ventricular polimórfica; signos/síntomas de arritmia potencialmente mortal (grado 4) | • Suspender VANFLYTA de forma permanente. |
| Reacciones adversas no hematológicas de grado 3 o 4 | • Interrumpir VANFLYTA. • Reanudar el tratamiento a la dosis previa si la reacción adversa mejora a grado ≤1. • Reanudar el tratamiento a una dosis reducida (ver la Tabla 3) si la reacción adversa mejora a grado <3. • Suspender de forma permanente si la reacción adversa de grado 3 o 4 dura más de 28 días y se sospecha que está asociada a VANFLYTA. |
| Neutropenia o trombocitopenia de grado 4 persistentes sin enfermedad activa de la médula ósea. | • Reducir la dosis (ver la Tabla 3). |
Clasificación según la versión 4.03 de los criterios comunes de terminología para acontecimientos adversos del
Instituto Nacional del Cáncer (NCI CTCAE v4.03).
Ajustes de dosis por reacciones adversas y/o uso concomitante con inhibidores potentes de CYP3A
Tabla 3: Ajustes de dosis según la fase por reacciones adversas y/o uso concomitante con inhibidores potentes de CYP3A durante el tratamiento con VANFLYTA
| Reducciones de dosis Inhibidores | Reacción adversa | |||||
| Fase de tratamiento | Dosis completa | Reacción adversa | potentes de CYP3A concomitantes | e inhibidores potentes de CYP3A concomitantes | ||
| Inducción o consolidación | 35,4 mg | 26,5 mg | 17,7 mg | Interrumpir | ||
| Mantenimiento (dos primeras semanas) | 26,5 mg | Interrumpir | 17,7 mg | Interrumpir | ||
| Mantenimiento (tras dos semanas) | 53 mg | 35,4 mg | 26,5 mg | 17,7 mg |
Dosis omitidas o vómitos
Si se omite una dosis de VANFLYTA o no se toma a la hora habitual, el paciente debe tomar la dosis lo antes posible el mismo día y volver a la pauta habitual al día siguiente. El paciente no debe tomar
dos dosis el mismo día.
Si el paciente vomita después de tomar VANFLYTA, el paciente no debe tomar una dosis adicional ese día, sino que debe tomar la siguiente dosis al día siguiente a la hora habitual.
Poblaciones especiales
Edad avanzada
No se requiere ajustar la dosis en pacientes de edad avanzada.
Insuficiencia hepática
No se recomienda ajustar la dosis en pacientes con insuficiencia hepática leve o moderada.
No se recomienda el uso de VANFLYTA en pacientes con insuficiencia hepática grave (clase C de
Child-Pugh), ya que no se ha establecido la seguridad y eficacia en esta población.
Insuficiencia renal
No se recomienda ajustar la dosis en pacientes con insuficiencia renal leve o moderada.
No se recomienda el uso de VANFLYTA en pacientes con insuficiencia renal grave
(CLcr <30 ml/min), calculada mediante la fórmula de Cockcroft-Gault), ya que no se ha establecido la seguridad y eficacia en esta población.
Población pediátrica
No se ha establecido la seguridad y eficacia de VANFLYTA en niños y adolescentes menores de
18 años de edad (ver sección 5.1). No se dispone de datos.
Forma de administración
VANFLYTA se administra por vía oral.
Los comprimidos se deben tomar aproximadamente a la misma hora cada día con o sin alimentos.
4.3 Contraindicaciones
• Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
• Síndrome de QT largo congénito (ver sección 4.4).
• Lactancia (ver sección 4.6).
4.4 Advertencias y precauciones especiales de empleo
Prolongación del intervalo QT
Quizartinib se asocia a prolongación del intervalo QT (ver sección 4.8). La prolongación del intervalo QT puede aumentar el riesgo de arritmias ventriculares o de torsade de pointes. Los pacientes con síndrome de QT largo congénito y/o antecedentes de torsade de pointes fueron excluidos del programa de desarrollo de quizartinib. No se debe utilizar VANFLYTA en pacientes con síndrome de QT largo congénito.
VANFLYTA se debe utilizar con precaución en pacientes que corren un riesgo significativo de desarrollar prolongación del intervalo QT. Esto incluye a los pacientes con enfermedad cardiovascular no controlada o importante (p. ej., antecedentes de bloqueo cardiaco de segundo o tercer grado [sin marcapasos], infarto de miocardio en los 6 meses anteriores, angina de pecho no controlada, hipertensión no controlada, insuficiencia cardiaca congestiva, antecedentes de arritmias ventriculares clínicamente relevantes o torsade de pointes) y a los pacientes que reciben medicamentos concomitantes que se sabe que prolongan el intervalo QT. Los electrolitos deben estar dentro de los valores de referencia (ver sección 4.2).
No se debe comenzar el tratamiento con VANFLYTA si el intervalo QTcF es superior a 450 ms. Durante la inducción y la consolidación, se deben realizar ECG antes de iniciar el tratamiento y luego
una vez por semana durante el tratamiento con quizartinib, o con mayor frecuencia si está clínicamente indicado.
Durante el mantenimiento, se deben realizar ECG antes de iniciar el tratamiento y luego una vez por semana durante el primer mes tras el inicio y el aumento de la dosis, y posteriormente si está clínicamente indicado. La dosis inicial de mantenimiento no se debe aumentar si el intervalo QTcF es superior a 450 ms (ver la Tabla 1).
Se debe suspender VANFLYTA de forma permanente en pacientes que desarrollan prolongación del intervalo QT con signos o síntomas de arritmia potencialmente mortal (ver sección 4.2).
El control del intervalo QT mediante ECG se debe realizar con mayor frecuencia en pacientes que corren un riesgo significativo de desarrollar prolongación del intervalo QT y torsade de pointes.
Se debe controlar y corregir la hipocalemia y la hipomagnesemia antes y durante el tratamiento con VANFLYTA. Se deben controlar los electrolitos y realizar ECG con mayor frecuencia en pacientes que presentan diarrea o vómitos.
Control mediante ECG si se utilizan medicamentos que prolongan el intervalo QT
Se debe controlar con mayor frecuencia mediante ECG a los pacientes si se requiere administrar
VANFLYTA junto con medicamentos que se sabe que prolongan el intervalo QT (ver sección 4.5).
Coadministración con inhibidores potentes de CYP3A
Se debe reducir la dosis de VANFLYTA cuando se utiliza de forma concomitante con inhibidores potentes de CYP3A, ya que pueden aumentar la exposición de quizartinib (ver secciones 4.2 y 4.5).
Infecciones en pacientes de edad avanzada
Se han producido infecciones mortales con quizartinib con mayor frecuencia en pacientes de edad avanzada (es decir, mayores de 65 años), en comparación con pacientes más jóvenes, especialmente al principio del periodo de tratamiento. Se debe vigilar estrechamente a los pacientes mayores de 65 años por si aparecen infecciones graves durante la inducción.
Mujeres en edad fértil/anticonceptivos en hombres y mujeres
Según los hallazgos observados en animales, quizartinib puede producir daños embriofetales si se administra a una mujer embarazada. Las mujeres en edad fértil se deben realizar pruebas de embarazo en los 7 días anteriores a comenzar el tratamiento con VANFLYTA. Las mujeres en edad fértil deben utilizar anticonceptivos efectivos durante el tratamiento con VANFLYTA y durante al menos 7 meses después de la última dosis. Los hombres cuyas parejas estén en edad fértil deben utilizar anticonceptivos efectivos durante el tratamiento con VANFLYTA y durante al menos 4 meses después de la última dosis (ver sección 4.6).
Tarjeta de información para el paciente
El médico prescriptor debe comentar los riesgos del tratamiento con VANFLYTA con el paciente. El paciente recibirá la tarjeta de información para el paciente con cada prescripción (incluida en el envase del medicamento).
4.5 Interacción con otros medicamentos y otras formas de interacción
Quizartinib y su metabolito activo AC886 se metabolizan principalmente por CYP3A in vitro. Efecto de otros medicamentos en VANFLYTA
Inhibidores potentes de CYP3A/glucoproteína P (P-gp)
La administración conjunta de ketoconazol (200 mg dos veces al día durante 28 días), un inhibidor potente de CYP3A/P-gp, con una dosis única de VANFLYTA aumentó la concentración plasmática máxima (Cmáx) y el área bajo la curva (AUCinf) de quizartinib en 1,17 veces y 1,94 veces, respectivamente, y disminuyó la Cmáx y el AUCinf de AC886 en 2,5 veces y 1,18 veces, respectivamente, en comparación con VANFLYTA en monoterapia. En estado estacionario, se calculó que la exposición de quizartinib (Cmáx y AUC0-24h) aumentó en 1,86 veces y 1,96 veces, respectivamente, y la exposición de AC886 (Cmáx y AUC0-24h) disminuyó en 1,22 veces y 1,17 veces, respectivamente. El aumento de la exposición de quizartinib puede aumentar el riesgo de toxicidad.
Se debe reducir la dosis de VANFLYTA, como se muestra en la tabla siguiente, si no se puede evitar el uso concomitante con inhibidores potentes de CYP3A. Para obtener más información sobre los ajustes de dosis, ver la Tabla 3 en la sección 4.2.
| Dosis completa | Reducciones de dosis en el uso concomitante con inhibidores potentes de CYP3A |
| 26,5 mg | 17,7 mg |
| 35,4 mg | 17,7 mg |
| 53 mg | 26,5 mg |
Entre los inhibidores potentes de CYP3A/P-gp se encuentran itraconazol, posaconazol, voriconazol, claritromicina, nefazodona, telitromicina y antirretrovirales (ciertos medicamentos utilizados para tratar el VIH pueden aumentar el riesgo de efectos adversos (p. ej., ritonavir) o reducir la eficacia
(p. ej., efavirenz o etravirina) de VANFLYTA).
Inhibidores moderados de CYP3A
La administración conjunta de fluconazol (200 mg dos veces al día durante 28 días), un inhibidor moderado de CYP3A, con una dosis única de VANFLYTA aumentó la Cmáx de quizartinib y AC886 en 1,11 veces y 1,02 veces, respectivamente, y el AUCinf en 1,20 veces y 1,14 veces, respectivamente. Este cambio no se consideró clínicamente relevante. No se recomienda modificar la dosis.
Inductores potentes o moderados de CYP3A
La administración conjunta de efavirenz (tratamiento inicial a 600 mg una vez al día durante 14 días),
un inductor moderado de CYP3A, con una dosis única de VANFLYTA disminuyó la Cmáx y el AUCinf
de quizartinib en aproximadamente 1,18 veces y 9,7 veces, respectivamente, en comparación con
VANFLYTA en monoterapia. La Cmáx y el AUCinf de AC886 disminuyeron en aproximadamente
3,1 veces y 26 veces, respectivamente (ver sección 5.2).
Una reducción de la exposición de quizartinib puede dar lugar a una reducción de la eficacia. Se debe evitar la administración conjunta de VANFLYTA con inductores potentes o moderados de CYP3A.
Entre los inductores potentes de CYP3A4 se encuentran apalutamida, carbamazepina, enzalutamida, mitotano, fenitoína, rifampicina y ciertos medicamentos a base de plantas como la hierba de San Juan (también conocida como Hypericum perforatum). Entre los inductores moderados de CYP3A4 se encuentran efavirenz, bosentán, etravirina, fenobarbital y primidona.
Medicamentos que prolongan el intervalo QT
La administración conjunta de VANFLYTA con otros medicamentos que prolongan el intervalo QT puede aumentar aún más la incidencia de prolongación del intervalo QT. Entre los medicamentos que prolongan el intervalo QT se encuentran los azoles antifúngicos, ondansetrón, granisetrón, azitromicina, pentamidina, doxiciclina, moxifloxacino, atovacuona, proclorperazina y tacrólimus. Se debe tener precaución al administrar medicamentos que prolongan el intervalo QT junto con VANFLYTA (ver sección 4.4).
Medicamentos que reducen los ácidos gástricos
El inhibidor de la bomba de protones lansoprazol disminuyó la Cmáx y el AUCinf de quizartinib en
1,16 veces y 1,05 veces, respectivamente. Este cambio en la absorción de quizartinib no se consideró
clínicamente relevante. No se recomienda modificar la dosis.
Efecto de VANFLYTA en otros medicamentos
Sustratos de la glucoproteína P (P-gp)
La administración conjunta de quizartinib y dabigatrán etexilato (un sustrato de la P-gp) aumentó la
Cmáx total y libre de dabigatrán en 1,12 veces y 1,13 veces, respectivamente, y aumentó el AUCinf total y libre de dabigatrán en 1,13 veces y 1,11 veces, respectivamente (ver sección 5.2). Quizartinib es un
inhibidor débil de la P-gp, y no se recomienda modificar la dosis cuando se administran sustratos de la
P-gp junto con VANFLYTA.
Sustratos de la proteína de resistencia al cáncer de mama (BCRP)
Los datos in vitro indican que quizartinib es un inhibidor de la BCRP. Actualmente, se desconoce la relevancia clínica de este hallazgo. Se debe tener precaución al administrar quizartinib junto con medicamentos que son sustratos de la BCRP.
4.6 Fertilidad, embarazo y lactancia
Mujeres en edad fértil/anticonceptivos en hombres y mujeres
Las mujeres en edad fértil se deben realizar pruebas de embarazo en los 7 días anteriores a comenzar el tratamiento con VANFLYTA.
Quizartinib puede producir daños embriofetales cuando se administra a una mujer embarazada (ver sección 5.3). Por lo tanto, las mujeres en edad fértil deben utilizar anticonceptivos efectivos durante el tratamiento con VANFLYTA y durante al menos 7 meses después de la última dosis.
Los hombres cuyas parejas están en edad fértil deben utilizar anticonceptivos efectivos durante el tratamiento con VANFLYTA y durante al menos 4 meses después de la última dosis.
Embarazo
No hay datos relativos al uso de quizartinib en mujeres embarazadas. En función de los hallazgos en animales, quizartinib puede producir toxicidad embriofetal si se administra a mujeres embarazadas (ver sección 5.3).
No debe utilizarse VANFLYTA durante el embarazo ni en mujeres en edad fértil que no estén utilizando métodos anticonceptivos, a no ser que la situación clínica de la mujer requiera tratamiento. Se debe informar a las mujeres embarazadas sobre el posible riesgo para el feto.
Lactancia
Se desconoce si quizartinib o sus metabolitos activos se excretan en la leche materna. No se puede excluir el riesgo en niños lactantes. Debido al potencial de reacciones adversas graves en los lactantes, las mujeres no deben dar el pecho durante el tratamiento con VANFLYTA ni durante al menos
5 semanas después de la última dosis (ver sección 4.3).
Fertilidad
No hay datos en seres humanos relativos al efecto de quizartinib en la fertilidad. En función de los hallazgos en animales, el tratamiento con VANFLYTA puede afectar a la fertilidad en mujeres y en hombres (ver sección 5.3).
4.7 Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de VANFLYTA sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
4.8 Reacciones adversas
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes fueron alanina aminotransferasa elevada (58,9 %), recuento plaquetario disminuido (40,0 %), disminución de hemoglobina (37,4 %), diarrea (37,0 %), náuseas (34,0 %), dolor abdominal (29,4 %), cefalea (27,5 %), vómitos (24,5 %) y recuento de neutrófilos disminuido (21,9 %).
Las reacciones adversas más frecuentes de grado 3 o 4 fueron recuento plaquetario disminuido (40 %), disminución de hemoglobina (35,5 %), recuento de neutrófilos disminuido (21,5 %), alanina aminotransferasa elevada (12,1 %), bacteriemia (7,2 %) e infecciones por hongos (5,7 %). Las reacciones adversas graves más frecuentes en el grupo de VANFLYTA fueron neutropenia (3,0 %), infecciones por hongos (2,3 %) e infecciones por herpes (2,3 %). Las reacciones adversas con desenlace mortal fueron infecciones por hongos (0,8 %) y parada cardiaca (0,4 %).
Las reacciones adversas más frecuentes asociadas a la interrupción de la dosis de VANFLYTA fueron neutropenia (10,6 %), trombocitopenia (4,5 %) e intervalo QT largo en el electrocardiograma (2,6 %). Las reacciones adversas más frecuentes asociadas a la reducción de la dosis fueron neutropenia
(9,1 %), trombocitopenia (4,5 %) e intervalo QT largo en el electrocardiograma (3,8 %).
La reacción adversa más frecuente asociada a la suspensión permanente de VANFLYTA fue trombocitopenia (1,1 %).
Tabla de reacciones adversas
Se investigó la seguridad de VANFLYTA en QuANTUM-First, un estudio doble ciego, aleatorizado y controlado con placebo en pacientes adultos con LMA FLT3-ITD positiva de nuevo diagnóstico.
Las reacciones adversas se enumeran de acuerdo con la clasificación por órganos y sistemas de MedDRA. Dentro de cada clasificación por órganos y sistemas, las reacciones adversas se presentan por frecuencia, con las reacciones más frecuentes en primer lugar, utilizando la siguiente convención: muy frecuentes (≥1/10), frecuentes (≥1/100 a <1/10), poco frecuentes (≥1/1000 a <1/100), raras
(≥1/10 000 a <1/1000), muy raras (<1/10 000), frecuencia no conocida (no puede estimarse a partir de los datos disponibles). Dentro de cada categoría de frecuencia, las reacciones adversas se presentan en
orden descendente de gravedad.
Tabla 4: Reacciones adversas
| Reacción adversa | Todos los grados % | Grado 3 o 4 % | Categoría de frecuencia (todos los grados) |
| Infecciones e infestaciones | |||
| Infección del tracto respiratorio superiora | 18,1 | 1,9 | Muy frecuentes |
| Infecciones por hongosb | 15,1 | 5,7 | Muy frecuentes |
| Infecciones por herpesc | 14,0 | 3,0 | Muy frecuentes |
| Bacteriemiad | 11,3 | 7,2 | Muy frecuentes |
| Trastornos de la sangre y del sistema linfático | |||
| Trombocitopeniae | 40,0 | 40,0 | Muy frecuentes |
| Anemiae | 37,4 | 35,5 | Muy frecuentes |
| Neutropeniae | 21,9 | 21,5 | Muy frecuentes |
| Pancitopenia | 2,6 | 2,3 | Frecuentes |
| Trastornos del metabolismo y de la nutrición | |||
| Apetito disminuido | 17,4 | 4,9 | Muy frecuentes |
| Trastornos del sistema nervioso | |||
| Cefaleaf | 27,5 | 0 | Muy frecuentes |
| Trastornos cardiacos | |||
| Parada cardiacag | 0,8 | 0,4 | Poco frecuentes |
| Fibrilación ventricularg | 0,4 | 0,4 | Poco frecuentes |
| Trastornos respiratorios, torácicos y mediastínicos | |||
| Epistaxis | 15,1 | 1,1 | Muy frecuentes |
| Trastornos gastrointestinales | |||
| Diarreah | 37,0 | 3,8 | Muy frecuentes |
| Náuseas | 34,0 | 1,5 | Muy frecuentes |
| Dolor abdominali | 29,4 | 2,3 | Muy frecuentes |
| Vómitos | 24,5 | 0 | Muy frecuentes |
| Dispepsia | 11,3 | 0,4 | Muy frecuentes |
| Trastornos hepatobiliares | |||
| ALT elevadae | 58,9 | 12,1 | Muy frecuentes |
| Trastornos generales y alteraciones en el lugar de administración | |||
| Edemaj | 18,9 | 0,4 | Muy frecuentes |
| Exploraciones complementarias | |||
| QT largo en el electrocardiogramak | 14,0 | 3,0 | Muy frecuentes |
Quimioterapia estándar = citarabina (arabinósido de citosina) y antraciclina (daunorubicina o idarubicina).
a Las infecciones del tracto respiratorio superior incluyen infección del tracto respiratorio superior,
nasofaringitis, sinusitis, rinitis, amigdalitis, laringofaringitis, faringitis bacteriana, faringoamigdalitis, faringitis vírica y sinusitis aguda.
b Las infecciones por hongos incluyen candidiasis oral, aspergilosis broncopulmonar, infección por hongos, candidiasis vulvovaginal, infección por Aspergillus, infección fúngica del tracto respiratorio inferior, infección fúngica oral, infección por cándida, infección cutánea por hongos, mucormicosis, candidiasis orofaríngea, aspergilosis oral, infección hepática fúngica, candidiasis hepatoesplénica, onicomicosis, fungemia, cándida sistémica y micosis sistémica.
c Las infecciones por herpes incluyen herpes oral, herpes zóster, infecciones por virus herpes, herpes simple,
infección por herpesvirus humano 6, herpes genital y dermatitis herpética.
d La bacteriemia incluye bacteriemia, bacteriemia por Klebsiella, bacteriemia por estafilococos, bacteriemia enterocócica, bacteriemia estreptocócica, bacteriemia relacionada con dispositivos, bacteriemia por Escherichia, bacteriemia por Corynebacterium y bacteriemia por Pseudomonas.
e Términos basados en datos de laboratorio.
f La cefalea incluye cefalea, cefalea de tensión y migraña.
g Un sujeto presentó dos acontecimientos (fibrilación ventricular y parada cardiaca).
h La diarrea incluye diarrea y diarrea hemorrágica.
d El dolor abdominal incluye dolor abdominal, dolor en la zona superior del abdomen, molestia abdominal, dolor en la zona inferior del abdomen y dolor gastrointestinal.
j El edema incluye edema periférico, edema de cara, edema, sobrecarga de líquidos, edema generalizado, edema localizado con hinchazón periférica e hinchazón facial.
k QT largo en el electrocardiograma incluye QT largo en el electrocardiograma e intervalo QT del
electrocardiograma anormal.
Descripción de reacciones adversas seleccionadas
Trastornos cardiacos
Quizartinib prolonga el intervalo QT en el ECG. Se notificaron reacciones adversas que surgieron durante el tratamiento de prolongación del intervalo QT de cualquier grado en el 14,0 % de los pacientes tratados con VANFLYTA, y el 3,0 % de los pacientes presentó reacciones de grado 3 o más graves. La prolongación del QT se asoció a la reducción de la dosis en 10 (3,8 %) pacientes, a la interrupción de la dosis en 7 (2,6 %) pacientes y a la suspensión en 2 (0,8 %) pacientes. Se observó QTcF >500 ms en el 2,3 % de los pacientes en función de la revisión central de los datos de ECG. Dos (0,8 %) pacientes tratados con VANFLYTA presentaron parada cardiaca con registro de fibrilación ventricular, uno de ellos con desenlace mortal, ambos en el contexto de hipocalemia grave. Se deben realizar ECG y controlar y corregir la hipocalemia y la hipomagnesemia antes y durante el tratamiento con VANFLYTA. Para las modificaciones posológicas en pacientes con prolongación del intervalo QT, ver sección 4.2.
Otras poblaciones especiales
Edad avanzada
Se han producido infecciones mortales con mayor frecuencia con quizartinib en pacientes de edad avanzada (es decir, mayores de 65 años de edad), en comparación con pacientes más jóvenes (13 %
frente a 5,7 %), especialmente en el periodo inicial del tratamiento.
Se debe vigilar estrechamente a los pacientes mayores de 65 años de edad por si aparecen infecciones graves durante la inducción.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
4.9 Sobredosis
No hay ningún antídoto conocido para las sobredosis de VANFLYTA. En caso de sobredosis importante, se deben proporcionar las medidas de apoyo necesarias, con interrupción del tratamiento, evaluación de la hematología y control mediante ECG, así como prestar atención a los electrolitos séricos y a los medicamentos concomitantes que puedan predisponer a los pacientes a la prolongación del intervalo QT y/o a torsade de pointes. Se debe tratar a los pacientes con cuidados sintomáticos y de apoyo (ver las secciones 4.2 y 4.4).
5. PROPIEDADES FARMACOLÓGICAS
5.1 Propiedades farmacodinámicas
Grupo farmacoterapéutico: Agentes antineoplásicos, inhibidores de la proteína quinasa, código ATC: L01EX11
Mecanismo de acción
Quizartinib es un inhibidor del receptor tirosina quinasa FLT3. Quizartinib y su metabolito principal, AC886, se unen de forma competitiva al lugar de unión de adenosina trifosfato (ATP) de FLT3 con gran afinidad. Quizartinib y AC886 inhiben la actividad de quinasa de FLT3, impidiendo la autofosforilación del receptor y, por tanto, inhibiendo la señalización adicional posterior del receptor FLT3 y bloqueando la proliferación celular dependiente de FLT3-ITD.
Efectos farmacodinámicos
Electrofisiología cardiaca
El análisis de la respuesta a la exposición de QuANTUM-First predijo una prolongación de 24,1 ms
del intervalo QTcF dependiente de la concentración (límite superior del intervalo de confianza [IC] del
90 % bilateral: 26,6 ms) con la Cmáx en estado estacionario de quizartinib (53 mg) durante la terapia de mantenimiento.
Eficacia clínica y seguridad
Se evaluó la eficacia y seguridad de quizartinib frente a placebo en un estudio de fase III, aleatorizado, doble ciego y controlado con placebo, QuANTUM-First. En el estudio participaron 539 pacientes adultos de entre 18 y 75 años de edad (el 25 % tenía 65 años de edad o más), a los que se había diagnosticado recientemente una LMA FLT3-ITD positiva, determinada prospectivamente mediante
un análisis del estudio clínico. Se aleatorizó a los pacientes (1:1) para recibir VANFLYTA 35,4 mg una vez al día (n = 268) o placebo (n = 271) durante dos semanas en cada ciclo en combinación con
quimioterapia estándar (inducción seguida de consolidación para los pacientes que respondían),
seguido de terapia de mantenimiento con VANFLYTA en monoterapia (26,5 mg una vez al día durante dos semanas y 53 mg una vez al día a partir de entonces) o placebo durante un máximo de
36 ciclos (28 días/ciclo).
Los pacientes recibieron hasta 2 ciclos de quimioterapia de inducción con daunorubicina los días 1,
2 y 3 o idarubicina los días 1, 2 y 3 y citarabina durante 7 días, seguida de un tratamiento posterior a la remisión que consistió en hasta 4 ciclos de quimioterapia de consolidación y/o TCMH. La quimioterapia de consolidación consistió en citarabina los días 1, 3 y 5. Los pacientes que se sometieron a un TCMH dejaron de recibir el tratamiento del estudio 7 días antes del inicio del
esquema de acondicionamiento. Consultar la ficha técnica o resumen de las características del producto para las recomendaciones posológicas de daunorubicina, idarubicina y citarabina.
Los dos grupos de tratamiento aleatorizado estaban bien equilibrados con respecto a los datos demográficos, las características de la enfermedad y los factores de estratificación basales. De los
539 pacientes, la mediana de edad era de 56 años de edad (intervalo: 20 a 75 años), el 26,1 % de los
pacientes del grupo de quizartinib y el 24 % de los pacientes del grupo de placebo tenían 65 años de edad o más; el 54,5 % eran mujeres y el 45,5 % hombres; el 59,7 % era de raza blanca, el 29,3 % asiáticos, el 1,3 % de raza negra o afroamericanos y el 9,7 % de otras razas. El 84 % de los pacientes tenía un estado funcional basal de ECOG (Grupo Oncológico Cooperativo del Este) de 0 o 1. La mayoría de los pacientes (72,4 %) tenía un estado de riesgo citogenético basal intermedio. La frecuencia de alelos variantes de FLT3-ITD (VAF) fue del 3-25 % en el 35,6 % de los pacientes, superior al 25-50 % en el 52,1 % de los pacientes y superior al 50 % en el 12,1 % de los pacientes.
La variable primaria de eficacia fue la supervivencia global (SG) definida como el tiempo desde la aleatorización hasta la muerte por cualquier causa.
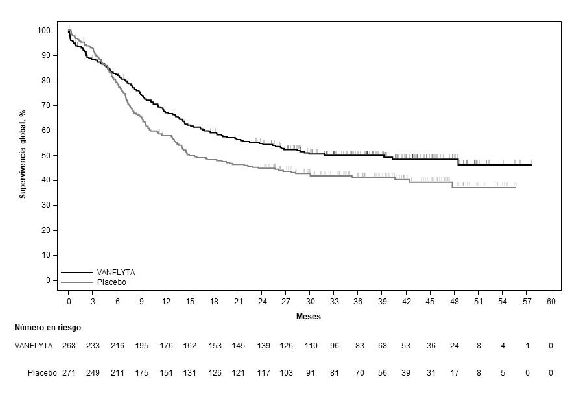
El estudio demostró una mejoría estadísticamente significativa en la SG para el grupo de quizartinib
(ver la Tabla 5 y la Figura 1). La mediana de tiempo de seguimiento del estudio fue de 39,2 meses.
Se observó una diferencia entre el grupo de quizartinib frente al grupo de placebo en las estimaciones de las tasas de supervivencia (IC del 95 %) en los momentos de referencia de 12, 24, 36 y 48 meses (ver la Tabla 5).
La tasa de remisión completa (RC) [IC del 95 %] para quizartinib fue del 54,9 % (147/268) [48,7;
60,9] frente al 55,4 % (150/271) [49,2; 61,4] para placebo.
Tabla 5: Resultados de eficacia de QuANTUM-First (población por intención de tratar)
| Quizartinib N = 268 | Placebo N = 271 | |
| SG (meses) | ||
| Mediana (IC del 95 %)a | 31,9 (21,0; NE) | 15,1 (13,2; 26,2) |
| HRb en relación con placebo (IC del 95 %) | 0,776 (0,615; 0,979) | |
| Valor p (prueba de rango logarítmico estratificado bilateral) | 0,0324 | |
| Tasa de SG (%) (IC del 95 %)a | ||
| 12 meses | 67,4 (61,3; 72,7) | 57,7 (51,6; 63,4) |
| 24 meses | 54,7 (48,4; 60,5) | 44,7 (38,7; 50,6) |
| 36 meses | 49,9 (43,7; 55,9) | 41,1 (35,0; 47,0) |
| 48 meses | 48,4 (41,9; 54,5) | 37,0 (29,8; 44,2) |
IC = intervalo de confianza; NE = no estimable
a Estimación de Kaplan-Meier
b El hazard ratio (HR) se basó en el modelo de regresión de Cox estratificado.
Figura 1: Curvas de Kaplan-Meier para la supervivencia global en QuANTUM-First
Población pediátrica
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con VANFLYTA en uno o más grupos de la población pediátrica en el tratamiento de la leucemia mieloide aguda (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
5.2 Propiedades farmacocinéticas
Se evaluó la farmacocinética de quizartinib y de su metabolito activo AC886 en voluntarios adultos sanos (dosis únicas) y en pacientes con LMA de nuevo diagnóstico (en estado estacionario).
Absorción
La biodisponibilidad absoluta de quizartinib de la formulación en comprimidos fue del 71 %. Tras la administración oral en condiciones de ayuno en sujetos sanos, el tiempo hasta la concentración máxima (mediana de tmáx) de quizartinib y AC886 determinada después de administrar la dosis fue de aproximadamente 4 horas (intervalo: 2 a8 horas) y de 5 a 6 horas (intervalo: 4 a 120 horas), respectivamente.
La administración de quizartinib con alimentos, en sujetos sanos, disminuyó la Cmáx de quizartinib en
1,09 veces, aumentó el AUCinf en 1,08 veces y retrasó el tmáx dos horas. Estos cambios en la exposición no se consideran clínicamente relevantes. Se puede administrar VANFLYTA con o sin
alimentos.
Basándose en el modelo de farmacocinética poblacional en pacientes con LMA de nuevo diagnóstico a
35,4 mg/día, en estado estacionario durante la terapia de inducción, la media geométrica (% CV) de la
Cmáx de quizartinib y AC886 se estimó en 140 ng/ml (71 %) y 163 ng/ml (52 %), respectivamente, y la media geométrica (% CV) del AUC0-24h fue de 2 680 ng•h/ml (85 %) y 3 590 ng•h/ml (51 %), respectivamente.
Durante la terapia de consolidación a 35,4 mg/día, en estado estacionario, la media geométrica (% CV)
de la Cmáx de quizartinib y AC886 se estimó en 204 ng/ml (64 %) y 172 ng/ml (47 %), respectivamente, y la media geométrica (% CV) del AUC0-24h fue de 3 930 ng•h/ml (78 %) y
3 800 ng•h/ml (46 %), respectivamente.
Durante la terapia de mantenimiento a 53 mg/día, en estado estacionario, la media geométrica (% CV) de la Cmáx de quizartinib y AC886 se estimó en 529 ng/ml (60 %) y 262 ng/ml (48 %), respectivamente, y la media geométrica (% CV) del AUC0-24h fue de 10 200 ng•h/ml (75 %) y
5 790 ng•h/ml (46 %), respectivamente.
Distribución
La unión in vitro de quizartinib y AC886 a las proteínas plasmáticas humanas es superior o igual al
99 %.
El cociente sangre/plasma de quizartinib y AC886 es dependiente de la concentración, lo que indica una saturación de la distribución a los eritrocitos. A concentraciones plasmáticas clínicamente relevantes, el cociente sangre/plasma es de aproximadamente 1,3 para quizartinib y de aproximadamente 2,8 para AC886. El cociente sangre/plasma de AC886 también depende del hematocrito, con una tendencia a aumentar a niveles de hematocrito más elevados.
La media geométrica (% CV) del volumen de distribución de quizartinib en sujetos sanos se calculó en 275 l (17 %).
Biotransformación
Quizartinib se metaboliza principalmente por CYP3A4 y CYP3A5 in vitro a través de las vías oxidativas, lo que produce el metabolito activo AC886, que se metaboliza a su vez por CYP3A4 y CYP3A5. El cociente AUC0-24h entre AC886 y quizartinib en estado estacionario durante la terapia de mantenimiento fue de 0,57.
Eliminación
Las semividas efectivas (t1/2) medias (DE) de quizartinib y AC886 son de 81 horas (73) y 136 horas (113), respectivamente, en pacientes con LMA de nuevo diagnóstico. Los cocientes de acumulación (AUC0-24h) medios (DE) de quizartinib y AC886 fueron de 5,4 (4,4) y 8,7 (6,8), respectivamente.
Quizartinib y sus metabolitos se eliminan principalmente por vía hepatobiliar y la mayor parte se excreta en las heces (76,3 % de la dosis radiactiva administrada por vía oral). Quizartinib inalterado en las heces representó aproximadamente el 4 % de la dosis radiactiva administrada por vía oral. La excreción renal es una vía de eliminación menor de la dosis radiactiva administrada (<2 %).
La media geométrica (% CV) del aclaramiento corporal total (CL) de quizartinib en sujetos sanos se calculó en 2,23 l/hora (29 %).
Linealidad/No linealidad
Quizartinib y AC886 mostró una cinética lineal en el intervalo de dosis de 26,5 mg a 79,5 mg en sujetos sanos y de 17,7 mg a 53 mg en pacientes con LMA.
Relaciones farmacocinéticas/farmacodinámicas
La edad (18 a 91 años), la raza, el sexo, el peso corporal o la insuficiencia renal (CLcr de 30 a
89 ml/min, calculada mediante Cockcroft-Gault) no tuvieron ningún efecto clínicamente relevante en la exposición de quizartinib y AC886 en función del análisis de farmacocinética poblacional.
Estudios de interacciones con otros medicamentos
Transportadores
Los estudios in vitro demostraron que quizartinib es un sustrato de la P-gp, pero no de BCRP, OATP1B1, OATP1B3, OCT1, OAT2, MATE1 o MRP2. AC886 es un sustrato de la BCRP, pero no de OATP1B1, OATP1B3, MATE1 o MRP2. Sin embargo, la administración de una dosis única de quizartinib con ketoconazol, un inhibidor potente tanto de CYP3A como de P-gp, aumentó la Cmáx de quizartinib en aproximadamente 1,17 veces, lo que sugiere que el efecto de la P-gp es mínimo. Como se requiere un ajuste de dosis para el uso concomitante con inhibidores potentes de CYP3A, muchos de los cuales también inhiben la P-gp, no se requiere un ajuste de dosis específico para los inhibidores de la P-gp.
Sustratos de la proteína de resistencia al cáncer de mama (BCRP)
Quizartinib inhibe la BCRP con una CI50 in vitro estimada de 0,813 μM. Dado que no se dispone de datos clínicos, no se puede descartar que quizartinib pueda inhibir este transportador a las dosis recomendadas.
Sustratos de la uridina difosfato glucuronosiltransferasa (UGT)1A1
Quizartinib inhibe la UGT1A1 con un Ki in vitro estimado de 0,78 μM. En función de un análisis farmacocinético de base fisiológica, se predijo que quizartinib aumentaba la Cmáx y el AUCinf de raltegravir (un sustrato de UGT1A1) en 1,03 veces, lo cual no se consideró clínicamente relevante.
Poblaciones especiales
Insuficiencia hepática
En un estudio de fase 1 con dosis únicas (26,5 mg), se evaluó la farmacocinética de quizartinib y de AC886 en sujetos con insuficiencia hepática leve (clase A de Child-Pugh) o moderada (clase B de Child-Pugh) en comparación con sujetos con función hepática normal. La exposición (Cmáx y AUCinf) de quizartinib y AC886 fue similar (diferencia ≤30 %) en todos los grupos. La unión de quizartinib y AC886 a las proteínas no se ve afectada por la insuficiencia hepática. Por lo tanto, la insuficiencia hepática no tuvo ningún efecto clínicamente relevante en la exposición de quizartinib y AC886.
No se recomienda ajustar la dosis en pacientes con insuficiencia hepática leve o moderada.
Los estudios clínicos no incluyeron pacientes con insuficiencia hepática grave (clase C de Child-Pugh)
y, por lo tanto, no se recomienda el uso de VANFLYTA en estos pacientes.
Insuficiencia renal
Un análisis de farmacocinética poblacional en pacientes con LMA con insuficiencia renal leve o moderada (CLcr de 30 a 89 ml/min) mostró que la función renal no afectaba al aclaramiento de
quizartinib y AC886. Por lo tanto, la insuficiencia renal leve o moderada no tuvo ningún efecto clínicamente relevante en la exposición de quizartinib y AC886. No se recomienda ajustar la dosis en
pacientes con insuficiencia renal leve o moderada.
Los estudios clínicos no incluyeron pacientes con insuficiencia renal grave (CLcr <30 ml/min) y, por lo tanto, no se recomienda el uso de VANFLYTA en estos pacientes.
5.3 Datos preclínicos sobre seguridad
En los estudios de genotoxicidad, quizartinib fue mutagénico en un ensayo de mutación inversa bacteriana, pero no en un ensayo de mutación celular en mamíferos (timidina quinasa de linfoma de ratón) ni en un ensayo de mutación en roedores transgénicos in vivo. Quizartinib no fue clastogénico ni indujo poliploidía en un ensayo de aberraciones cromosómicas y tampoco fue clastogénico o aneugénico en un ensayo de micronúcleos de médula ósea en ratas con dosis únicas. Un ensayo de micronúcleos de médula ósea in vivo en ratas resultó equívoco tras dosis repetidas durante 28 días. Tras una dosis única más alta, el resultado fue negativo.
No se han realizado estudios de fertilidad en animales con quizartinib. Sin embargo, se observaron hallazgos adversos en los sistemas reproductores masculinos y femeninos en los estudios de toxicidad a dosis repetidas en ratas y monos. En ratas hembra, se observaron quistes en los ovarios y modificaciones en la mucosa vaginal con dosis de aproximadamente 10 veces la dosis humana recomendada (DHR) en función del AUC. Los hallazgos en los monos hembra incluyeron atrofia uterina, ovárica y vaginal, que se observaron a dosis aproximadamente 0,3 veces la DHR en función del AUC. Los correspondientes niveles sin efecto adverso observado (NOAEL) para estos cambios fueron 1,5 veces y 0,1 veces la DHR, respectivamente, en función del AUC. En ratas macho, se observaron degeneración de los túbulos seminíferos de los testículos y ausencia de liberación de espermatozoides a dosis aproximadamente 8 veces la DHR en función del AUC. Los hallazgos en los monos macho incluyeron depleción de las células germinales en los testículos, que se observó a dosis aproximadamente 0,5 veces la DHR en función del AUC. Los correspondientes NOAEL para estos cambios fueron 1,4 veces y 0,1 veces la DHR, respectivamente, en función del AUC. Tras un periodo de recuperación de cuatro semanas, todos estos hallazgos, excepto las modificaciones de la mucosa vaginal en las ratas hembra, fueron reversibles.
En estudios de toxicidad embriofetal, se observaron mortalidad embriofetal y un aumento de las pérdidas posimplantación a dosis maternalmente tóxicas. Se observaron fetotoxicidad (menor peso fetal, efectos en la osificación esquelética) y teratogenicidad (anomalías fetales, incluido edema) a dosis aproximadamente 3 veces la DHR en función del AUC. El NOAEL fue 0,5 veces la DHR en función del AUC. Quizartinib se considera potencialmente teratogénico.
Estudios de toxicología en animales
En los estudios de toxicidad a dosis repetidas, se observó toxicidad en los órganos hematopoyéticos y linfoides, incluidas disminución de las células sanguíneas periféricas e hipocelularidad de la médula ósea; toxicidad hepática, incluidas aminotransferasas elevadas, necrosis hepatocelular y deposición de cristales birrefringentes (perros); y toxicidad renal, incluidas basofilia tubular y deposición de cristales birrefringentes (ratas macho). Estos cambios se observaron a aproximadamente 0,4 veces, 0,4 veces y
9 veces la DHR, respectivamente, en función del AUC. Los correspondientes NOAEL fueron aproximadamente 0,1 veces, 0,1 veces y 1,5 veces la DHR, respectivamente, en función del AUC.
Los estudios de evaluación del riesgo medioambiental han demostrado que quizartinib puede suponer un riesgo para el medio acuático.
Estudios de farmacología de seguridad in vitro y en animales
En los estudios de farmacología de seguridad cardiovascular realizados en monos Cynomolgus, quizartinib produjo una prolongación del QT a dosis aproximadamente 2 veces superiores a la DHR de
53 mg/día en función de la Cmáx. El NOAEL fue aproximadamente 0,4 veces la DHR en función de la
Cmáx. Quizartinib inhibió principalmente la IKs con una inhibición máxima del 67,5 % a 2,9 µM. La inhibición máxima de la IKs por AC886 fue del 26,9 % a 2,9 µM. Quizartinib y AC886, a 3 μM, inhibieron de forma estadísticamente significativa la corriente hERG en un 16,4 % y un 12,0 %, respectivamente. Ni quizartinib ni AC886 inhibieron la INa, INa-L e ICa-L a ninguna de las concentraciones probadas.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
VANFLYTA 17,7 mg comprimidos recubiertos con película
Núcleo del comprimido
Hidroxipropilbetadex
Celulosa microcristalina (E460) Estearato de magnesio
Recubrimiento con película
Hipromelosa (E464) Talco (E553b) Triacetina (E1518)
Dióxido de titanio (E171)
VANFLYTA 26,5 mg comprimidos recubiertos con película
Núcleo del comprimido
Hidroxipropilbetadex
Celulosa microcristalina (E460) Estearato de magnesio
Recubrimiento con película
Hipromelosa (E464) Talco (E553b) Triacetina (E1518)
Dióxido de titanio (E171) Óxido de hierro amarillo E172
6.2 Incompatibilidades
No procede.
6.3 Periodo de validez
3 años.
6.4 Precauciones especiales de conservación
No requiere condiciones especiales de conservación.
6.5 Naturaleza y contenido del envase
Blísteres unidosis de aluminio/aluminio perforados. VANFLYTA 17,7 mg comprimidos recubiertos con película
Cajas que contienen 14 x 1 o 28 x 1 comprimidos recubiertos con película.
VANFLYTA 26,5 mg comprimidos recubiertos con película
Cajas que contienen 14 x 1, 28 x 1 o 56 x 1 comprimidos recubiertos con película. Puede que solamente estén comercializados algunos tamaños de envases.
6.6 Precauciones especiales de eliminación
Este medicamento puede suponer un riesgo para el medio ambiente. La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Daiichi Sankyo Europe GmbH Zielstattstrasse 48
81379 Munich
Alemania
8. NÚMEROS DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/23/1768/001-005
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 06/noviembre/2023
10. FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia
Europea de Medicamentos https://www.ema.europa.eu.
ANEXO II
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
A. FABRICANTE RESPONSABLE DE LA LIBERACIÓN DE LOS LOTES
Nombre y dirección del fabricante responsable de la liberación de los lotes
Daiichi Sankyo Europe GmbH Luitpoldstrasse 1
85276 Pfaffenhofen
Alemania
B. CONDICIONES O RESTRICCIONES DE SUMINISTRO Y USO
Medicamento sujeto a prescripción médica restringida (ver Anexo I: Ficha Técnica o Resumen de las
Características del Producto, sección 4.2).
C. OTRAS CONDICIONES Y REQUISITOS DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
• Informes periódicos de seguridad (IPSs)
Los requerimientos para la presentación de los IPSs para este medicamento se establecen en la lista de fechas de referencia de la Unión (lista EURD) prevista en el artículo 107quater, apartado 7, de la Directiva 2001/83/CE y cualquier actualización posterior publicada en el portal web europeo sobre medicamentos.
El titular de la autorización de comercialización (TAC) presentará el primer IPS para este medicamento en un plazo de 6 meses después de la autorización.
D. CONDICIONES O RESTRICCIONES EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
• Plan de gestión de riesgos (PGR)
El titular de la autorización de comercialización (TAC) realizará las actividades e intervenciones de farmacovigilancia necesarias según lo acordado en la versión del PGR incluido en el Módulo 1.8.2 de la autorización de comercialización y en cualquier actualización del PGR que se acuerde posteriormente.
Se debe presentar un PGR actualizado:
• A petición de la Agencia Europea de Medicamentos.
• Cuando se modifique el sistema de gestión de riesgos, especialmente como resultado de nueva información disponible que pueda conllevar cambios relevantes en el perfil beneficio/riesgo, o como resultado de la consecución de un hito importante (farmacovigilancia o minimización de riesgos).
• Medidas adicionales de minimización de riesgos
Antes del lanzamiento de VANFLYTA en cada Estado miembro, el titular de la autorización de comercialización (TAC) debe acordar con la autoridad nacional competente el contenido y el formato del programa informativo, incluidos los medios de comunicación, las modalidades de distribución y cualquier otro aspecto del programa.
El programa informativo tiene por objeto reforzar el conocimiento del médico prescriptor y del paciente/cuidador sobre el riesgo de reacciones adversas al medicamento (RAM) graves de
prolongación del intervalo QTc y las medidas que se deben tomar para minimizar la aparición de este riesgo en los pacientes que reciben VANFLYTA.
El TAC debe garantizar que, en cada Estado miembro en el que se comercializa VANFLYTA, todos los profesionales sanitarios y pacientes/cuidadores que se espera que prescriban, dispensen y utilicen VANFLYTA reciban/tengan acceso al siguiente paquete informativo:
• Material informativo para médicos
• Paquete informativo para pacientes
Material informativo para médicos
• Ficha técnica o resumen de las características del producto.
• Guía para los profesionales sanitarios.
La guía para los profesionales sanitarios contendrá los siguientes elementos clave:
o Descripción de las RAM graves relacionadas con la prolongación del intervalo QTc que han ocurrido con quizartinib.
o Descripción detallada de la pauta posológica recomendada de VANFLYTA: dosis inicial y criterios para aumentar la dosis.
o Descripción detallada sobre la interrupción de la dosis, la reducción de la dosis y la suspensión del tratamiento con VANFLYTA en función de la duración del intervalo Qtc.
o Modificación posológica de VANFLYTA con el uso concomitante de inhibidores potentes de CYP3A.
o Tratamiento con otros medicamentos concomitantes que se sabe que prolongan el intervalo QT.
o Frecuencia del control con ECG.
o Control y manejo de los electrolitos séricos.
Paquete informativo para pacientes:
• Prospecto.
• Tarjeta de información para el paciente.
La tarjeta de información para el paciente contendrá los siguientes elementos clave:
o Mensaje de advertencia para los profesionales sanitarios de que el tratamiento con VANFLYTA puede aumentar el riesgo de RAM graves relacionadas con la prolongación del intervalo QTc.
o Información importante para profesionales sanitarios no implicados en la asistencia habitual del paciente sobre el manejo del paciente con respecto a la prolongación del intervalo QTc.
o Información importante para pacientes/cuidadores sobre los signos o los síntomas de RAM graves relacionadas con la prolongación del intervalo QTc y cuándo acudir a un profesional sanitario.
o Información de contacto del médico prescriptor de VANFLYTA.
ANEXO III ETIQUETADO Y PROSPECTO
A. ETIQUETADO
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
CAJA EXTERIOR

1. NOMBRE DEL MEDICAMENTO
![]()
![]()
VANFLYTA 17,7 mg comprimidos recubiertos con película quizartinib
2. PRINCIPIO(S) ACTIVO(S)
![]()
Cada comprimido recubierto con película contiene 17,7 mg de quizartinib (como dihidrocloruro).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
![]()
Comprimidos recubiertos con película
14 x 1 comprimidos recubiertos con película
![]()
28 x 1 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
![]()
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
![]()
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
![]()
![]()
EXP
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA

11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
![]()
Daiichi Sankyo Europe GmbH
![]()
81366 Munich, Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/23/1768/001 14 x 1 comprimidos recubiertos con película
![]()
EU/1/23/1768/002 28 x 1 comprimidos recubiertos con película
![]()
13. NÚMERO DE LOTE
![]()
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
![]()
16. INFORMACIÓN EN BRAILLE
![]()
![]()
vanflyta 17,7 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
![]()
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC SN NN
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERES O TIRAS
BLÍSTER

1. NOMBRE DEL MEDICAMENTO
![]()
![]()
VANFLYTA 17,7 mg comprimidos quizartinib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
![]()
Daiichi-Sankyo (logotipo)
3. FECHA DE CADUCIDAD
![]()
EXP
4. NÚMERO DE LOTE
![]()
Lot
5. OTROS
INFORMACIÓN QUE DEBE FIGURAR EN EL EMBALAJE EXTERIOR
CAJA EXTERIOR

1. NOMBRE DEL MEDICAMENTO
![]()
![]()
VANFLYTA 26,5 mg comprimidos recubiertos con película quizartinib
2. PRINCIPIO(S) ACTIVO(S)
![]()
Cada comprimido recubierto con película contiene 26,5 mg de quizartinib (como dihidrocloruro).
3. LISTA DE EXCIPIENTES
4. FORMA FARMACÉUTICA Y CONTENIDO DEL ENVASE
![]()
Comprimidos recubiertos con película
![]()
14 x 1 comprimidos recubiertos con película
28 x 1 comprimidos recubiertos con película
![]()
56 x 1 comprimidos recubiertos con película
5. FORMA Y VÍA(S) DE ADMINISTRACIÓN
![]()
Leer el prospecto antes de utilizar este medicamento. Vía oral
6. ADVERTENCIA ESPECIAL DE QUE EL MEDICAMENTO DEBE MANTENERSE FUERA DE LA VISTA Y DEL ALCANCE DE LOS NIÑOS
![]()
Mantener fuera de la vista y del alcance de los niños.
7. OTRA(S) ADVERTENCIA(S) ESPECIAL(ES), SI ES NECESARIO
8. FECHA DE CADUCIDAD
![]()
![]()
EXP
9. CONDICIONES ESPECIALES DE CONSERVACIÓN
10. PRECAUCIONES ESPECIALES DE ELIMINACIÓN DEL MEDICAMENTO NO UTILIZADO Y DE LOS MATERIALES DERIVADOS DE SU USO, CUANDO CORRESPONDA

11. NOMBRE Y DIRECCIÓN DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
![]()
Daiichi Sankyo Europe GmbH
![]()
81366 Munich, Alemania
12. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
![]()
EU/1/23/1768/003 14 x 1 comprimidos recubiertos con película EU/1/23/1768/004 28 x 1 comprimidos recubiertos con película EU/1/23/1768/005 56 x 1 comprimidos recubiertos con película

13. NÚMERO DE LOTE
![]()
Lot
14. CONDICIONES GENERALES DE DISPENSACIÓN
15. INSTRUCCIONES DE USO
![]()
16. INFORMACIÓN EN BRAILLE
![]()
![]()
vanflyta 26,5 mg
17. IDENTIFICADOR ÚNICO - CÓDIGO DE BARRAS 2D
![]()
Incluido el código de barras 2D que lleva el identificador único.
18. IDENTIFICADOR ÚNICO - INFORMACIÓN EN CARACTERES VISUALES
PC SN NN
INFORMACIÓN MÍNIMA A INCLUIR EN BLÍSTERES O TIRAS
BLÍSTER

1. NOMBRE DEL MEDICAMENTO
![]()
![]()
VANFLYTA 26,5 mg comprimidos quizartinib
2. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
![]()
Daiichi-Sankyo (logotipo)
3. FECHA DE CADUCIDAD
![]()
EXP
4. NÚMERO DE LOTE
![]()
Lot
5. OTROS
TARJETA DE INFORMACIÓN PARA EL PACIENTE
![]()
TARJETA DE INFORMACIÓN PARA EL PACIENTE VANFLYTA
quizartinib
• Lleve siempre esta tarjeta con usted.
• Esta tarjeta contiene información importante de seguridad que debe conocer antes de tomar
VANFLYTA y durante el tratamiento con VANFLYTA.
• Enseñe esta tarjeta a cualquier médico, farmacéutico o cirujano antes de cualquier intervención médica o tratamiento.
Información del paciente
Nombre del paciente: Fecha de nacimiento:
En caso de emergencia, póngase en contacto con: Nombre:
Número de teléfono:
Información sobre el tratamiento
(A completar por el médico o por el paciente)
Se ha prescrito VANFLYTA a una dosis una vez al día de: mg
El tratamiento empezó en: /(MM/AA)
Información del médico prescriptor
(A completar por el médico o por el paciente)
Para más información o en caso de emergencia, póngase en contacto con: Nombre del médico:
Número de teléfono:
Información importante para el paciente
VANFLYTA puede causar una actividad eléctrica anómala en su corazón llamada “intervalo QT largo”, que puede ocasionar un trastorno del ritmo cardiaco potencialmente mortal. Por lo tanto, es muy importante comprobar periódicamente la actividad eléctrica de su corazón con un electrocardiograma (ECG).
Póngase en contacto inmediatamente con su médico si:
• tiene sensación de mareo, de aturdimiento o de desmayo;
• siente un cambio en el ritmo del corazón, p. ej., palpitaciones o una anomalía en su pulso. Puede sentir que su corazón late demasiado deprisa, pero también puede sentir un cambio impreciso o menos específico;
• se ha desmayado o perdido el conocimiento, aunque fuera solo durante un periodo de tiempo muy breve, p. ej., unos segundos;
• tiene diarrea o vómitos, o no puede comer o beber líquidos en cantidades suficientes;
• siente cualquier otro cambio repentino en su bienestar;
• un médico que no sea el médico prescriptor de VANFLYTA le cambia la medicación.
Consulte primero con su médico antes de tomar VANFLYTA junto con otros medicamentos, incluso los obtenidos sin receta o los suplementos, ya que estos pueden aumentar el riesgo de que desarrolle una prolongación del intervalo QT.
Para más información, leer el prospecto antes de utilizar este medicamento. Información importante para los profesionales sanitarios
VANFLYTA se asocia a prolongación del intervalo QT, lo que puede aumentar el riesgo de arritmias ventriculares o de torsade de pointes.
• Interrumpir VANFLYTA si el intervalo QTcF es ≥501 ms y suspender permanentemente si se asocia a torsade de pointes, taquicardia ventricular polimórfica o signos/síntomas de arritmia potencialmente mortal. VANFLYTA está contraindicado en pacientes con síndrome de QT largo congénito.
• Durante el tratamiento con VANFLYTA, comprobar los electrolitos séricos y corregir cualquier hipocalemia e hipomagnesemia según proceda.
• Evitar medicamentos no esenciales que prolonguen el intervalo QT. Si no se puede prescindir de ellos, realizar ECG con frecuencia.
• La dosis de VANFLYTA se debe reducir si se utiliza concomitantemente con inhibidores potentes de CYP3A.
Para más información, consulte la ficha técnica o resumen de las características del producto
(RCP).
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver el prospecto para obtener información sobre cómo notificar las reacciones adversas.
Daiichi-Sankyo (logotipo)
B. PROSPECTO
Prospecto: información para el paciente
VANFLYTA 17,7 mg comprimidos recubiertos con película VANFLYTA 26,5 mg comprimidos recubiertos con película quizartinib
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Puede contribuir comunicando los efectos adversos que pudiera usted tener. La parte final de la sección 4 incluye información sobre cómo comunicar estos efectos adversos.
Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted.
• Conserve este prospecto, ya que puede tener que volver a leerlo.
• Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
• Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
• Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
1. Qué es VANFLYTA y para qué se utiliza
2. Qué necesita saber antes de empezar a tomar VANFLYTA
3. Cómo tomar VANFLYTA
4. Posibles efectos adversos
5. Conservación de VANFLYTA
6. Contenido del envase e información adicional
 1. Qué es VANFLYTA y para qué se utiliza
1. Qué es VANFLYTA y para qué se utiliza
Qué es VANFLYTA
VANFLYTA contiene el principio activo quizartinib. Es un tipo de medicamento para el cáncer llamado “inhibidor de la proteína quinasa”. El medicamento se utiliza junto con quimioterapia para tratar adultos que tienen leucemia mieloide aguda (LMA, un tipo de cáncer de la sangre), con una mutación (cambio) en el gen FLT3 llamada “FLT3-ITD”. También se puede continuar el tratamiento con VANFLYTA tras un trasplante de médula ósea cuando los pacientes se hayan recuperado lo suficiente.
Su médico analizará con anterioridad sus células cancerosas en busca de cambios en el gen FLT3 para detectar mutaciones FLT3-ITD y asegurarse de que VANFLYTA es adecuado para usted.
Como actúa VANFLYTA
En la LMA, el cuerpo produce una gran cantidad de glóbulos blancos defectuosos que no maduran para convertirse en células sanas. VANFLYTA actúa bloqueando la acción de algunas proteínas llamadas “tirosina quinasas” en estas células defectuosas. Esto ralentiza o frena la división y el crecimiento incontrolable de las células defectuosas y ayuda a las células inmaduras a convertirse en células normales.
 2. Qué necesita saber antes de empezar a tomar VANFLYTA No tome VANFLYTA
2. Qué necesita saber antes de empezar a tomar VANFLYTA No tome VANFLYTA
• si es alérgico a quizartinib o a alguno de los demás componentes de este medicamento (incluidos en la sección 6). Si cree que puede ser alérgico, consulte a su médico para que le aconseje;
• si cree que nació con un problema de corazón llamado “síndrome de QT largo” (actividad eléctrica anómala del corazón que afecta al ritmo);
• si está en periodo de lactancia (ver “Embarazo, lactancia y fertilidad”).
Advertencias y precauciones
Consulte a su médico, farmacéutico o enfermero antes de empezar a tomar VANFLYTA:
• si tiene o ha tenido algún problema de corazón, como arritmia (ritmo cardiaco anómalo), infarto de miocardio (ataque al corazón) en los 6 meses anteriores, insuficiencia cardiaca congestiva (el corazón no bombea con suficiente fuerza), angina de pecho no controlada (dolor de pecho) o hipertensión no controlada (tensión arterial demasiado alta);
• si alguna vez le han dicho que tiene los niveles de potasio o magnesio en sangre bajos;
• si está tomando medicamentos que pueden prolongar el intervalo QT (ritmo cardiaco irregular;
ver “Otros medicamentos y VANFLYTA”);
• si está tomando inhibidores potentes del CYP3A (ver “Otros medicamentos y VANFLYTA”);
• si tiene o ha tenido fiebre, tos, dolor de pecho, falta de aliento, cansancio o dolor al orinar.
Control durante el tratamiento con VANFLYTA
Análisis de sangre
Su médico le realizará análisis de sangre periódicamente durante el tratamiento con VANFLYTA para controlar sus células sanguíneas (glóbulos blancos, glóbulos rojos y plaquetas) y electrolitos (sales
como sodio, potasio, magnesio, calcio, cloruro y bicarbonato en la sangre). Su médico le controlará los
electrolitos con más frecuencia si presenta diarrea o vómitos.
Electrocardiograma
Antes y durante el tratamiento, su médico comprobará su corazón con un electrocardiograma (ECG) para asegurarse de que su corazón late con normalidad. Los ECG se realizarán semanalmente al principio y con menor frecuencia después, según determine su médico. Su médico comprobará su corazón con más frecuencia si está tomando otros medicamentos que prolongan el intervalo QT (ver “Otros medicamentos y VANFLYTA”).
Infecciones en pacientes mayores de 65 años de edad
Los pacientes de edad avanzada corren un mayor riesgo de sufrir infecciones muy graves en comparación con los pacientes más jóvenes, especialmente en el periodo inicial del tratamiento. Si
tiene más de 65 años de edad se le vigilará estrechamente por si aparecen infecciones graves durante la
inducción.
Niños y adolescentes
No dé este medicamento a niños o adolescentes menores de 18 años de edad porque no hay suficiente información de uso en este grupo de edad.
Otros medicamentos y VANFLYTA
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento, incluidos los medicamentos adquiridos sin receta, vitaminas, antiácidos (medicamentos utilizados para el ardor y la acidez de estómago) y suplementos a base de plantas. Esto se debe a que algunos medicamentos pueden afectar a la forma de actuar de VANFLYTA.
En particular, los siguientes medicamentos pueden aumentar el riesgo de efectos adversos con
VANFLYTA al aumentar los niveles de este medicamento en la sangre:
• ciertos medicamentos utilizados para tratar las infecciones por hongos, como itraconazol, posaconazol o voriconazol;
• ciertos antibióticos, como claritromicina o telitromicina;
• nefazodona, un medicamento que se usa para tratar la depresión mayor.
Los siguientes medicamentos pueden reducir la eficacia de VANFLYTA:
• ciertos medicamentos utilizados para tratar la tuberculosis, como rifampicina;
• ciertos medicamentos utilizados para tratar las convulsiones o la epilepsia, como carbamazepina, primidona, fenobarbital o fenitoína;
• algunos medicamentos para tratar el cáncer de próstata, como apalutamida y enzalutamida;
• mitotano, un medicamento que se usa para el tratamiento de los síntomas de los tumores de los glándulas suprarrenales;
• bosentán, un medicamento utilizado para tratar la tensión arterial alta en los pulmones
(hipertensión arterial pulmonar);
• hierba de San Juan (Hypericum perforatum), un producto a base de plantas utilizado para la ansiedad y la depresión leve.
Ciertos medicamentos utilizados para tratar el VIH pueden aumentar el riesgo de efectos adversos
(p. ej., ritonavir) o reducir la eficacia (p. ej., efavirenz o etravirina) de VANFLYTA.
Medicamentos que prolongan el intervalo QT
La administración conjunta de VANFLYTA con otros medicamentos que prolongan el intervalo QT puede aumentar aún más el riesgo de prolongación del intervalo QT. Entre los medicamentos que prolongan el intervalo QT se encuentran los azoles antifúngicos, ondansetrón, granisetrón, azitromicina, pentamidina, doxiciclina, moxifloxacino, atovacuona, proclorperazina y tacrólimus.
Embarazo, lactancia y fertilidad
Embarazo
No debe tomar VANFLYTA durante el embarazo. Esto se debe a que puede dañar al feto. Las mujeres en edad fértil se deben hacer una prueba de embarazo en los 7 días anteriores a tomar este medicamento.
Las mujeres deben utilizar métodos anticonceptivos efectivos durante el tratamiento con VANFLYTA y al menos durante 7 meses tras finalizar el tratamiento. Los hombres deben utilizar métodos anticonceptivos efectivos durante el tratamiento con VANFLYTA y al menos durante 4 meses tras finalizar el tratamiento.
Si está embarazada, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico, farmacéutico o enfermero antes de utilizar este medicamento.
Lactancia
No dé el pecho durante el tratamiento con VANFLYTA, ni al menos durante 5 semanas tras finalizar el tratamiento. Esto se debe a que se desconoce si VANFLYTA se excreta en la leche materna (ver
“No tome VANFLYTA”).
Si está en periodo de lactancia, consulte a su médico, farmacéutico o enfermero antes de utilizar este medicamento.
Fertilidad
VANFLYTA puede reducir la fertilidad en hombres y mujeres. Debe comentar esto con su médico antes de comenzar el tratamiento.
Conducción y uso de máquinas
Es poco probable que VANFLYTA afecte a su capacidad para conducir o utilizar máquinas.
 3. Cómo tomar VANFLYTA
3. Cómo tomar VANFLYTA
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico o farmacéutico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
Cuánto VANFLYTA tomar
Su médico o farmacéutico le indicará exactamente cuánto VANFLYTA debe tomar. No modifique la dosis ni deje de tomar VANFLYTA sin hablar antes con su médico.
Por lo general, comenzará tomando 35,4 mg (dos comprimidos de 17,7 mg) una vez al día durante
2 semanas durante cada ciclo de quimioterapia. La dosis máxima recomendada es 53 mg una vez al día.
Su médico puede indicarle que comience con una dosis menor de un comprimido de 17,7 mg una vez al día si está tomando ciertos medicamentos.
Una vez finalizada la quimioterapia, su médico puede cambiarle la dosis a un comprimido de 26,5 mg una vez al día durante 2 semanas y, a continuación, aumentarle la dosis a 53 mg (dos comprimidos de
26,5 mg) una vez al día, en función de cómo responda a VANFLYTA.
Su médico puede interrumpirle temporalmente el tratamiento o cambiarle la dosis en función de los análisis de sangre, los efectos adversos o de otros medicamentos que pueda estar tomando.
Su médico interrumpirá el tratamiento si se va a someter a un trasplante de células madre. Su médico le indicará cuándo debe dejar de tomar el medicamento y cuándo debe reiniciarlo.
Toma de este medicamento
• Tome VANFLYTA por vía oral (boca), con o sin alimentos.
• Tome VANFLYTA aproximadamente a la misma hora cada día. Le ayudará a recordar que debe tomarse el medicamento.
• Si vomita después de tomar el medicamento, no tome más comprimidos hasta la hora de la siguiente toma.
Cuánto tiempo se debe tomar VANFLYTA
Siga tomando VANFLYTA durante el tiempo indicado por su médico. Su médico controlará periódicamente su enfermedad para comprobar que el tratamiento continúa funcionando.
Si tiene alguna pregunta sobre el tiempo que debe tomar VANFLYTA, consulte a su médico o farmacéutico.
Si toma más VANFLYTA del que debe
Si, accidentalmente, toma más comprimidos de los que debe, o si alguna otra persona, accidentalmente, se toma su medicamento, consulte a un médico inmediatamente o acuda al hospital y lleve este prospecto con usted. Puede ser necesario un tratamiento médico.
Si olvidó tomar VANFLYTA
Si se olvida tomar VANFLYTA, tómelo lo antes posible el mismo día. Tome la siguiente dosis a la hora habitual al día siguiente.
No tome una dosis adicional (dos dosis el mismo día) para compensar las dosis olvidadas.
Si interrumpe el tratamiento con VANFLYTA
El dejar de tomar el tratamiento con VANFLYTA puede hacer que su enfermedad empeore. No deje de tomar su medicamento a menos que su médico se lo indique.
Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
 4. Posibles efectos adversos
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Efectos adversos graves
Informe a su médico, farmacéutico o enfermero inmediatamente si observa alguno de los siguientes efectos adversos:
• sensación de mareo, de aturdimiento o de desmayo. Podrían ser signos de un problema de corazón llamado “intervalo QT largo” (actividad eléctrica anómala del corazón que afecta al ritmo);
• fiebre, tos, dolor de pecho, falta de aliento, cansancio o dolor al orinar. Podrían ser signos de una infección o de neutropenia febril (recuentos bajos de glóbulos blancos con fiebre).
Efectos adversos muy frecuentes
(pueden afectar a más de 1 de cada 10 personas)
• aumento de la alanina aminotransferasa (resultados anómalos de las enzimas hepáticas);
• trombocitopenia (niveles bajos de plaquetas en la sangre);
• anemia (niveles bajos de glóbulos rojos);
• neutropenia (niveles bajos de neutrófilos, un tipo de glóbulo blanco);
• diarrea;
• náuseas (ganas de vomitar);
• dolor abdominal (de estómago);
• dolor de cabeza;
• vómitos;
• edema (hinchazón de la cara, los brazos y las piernas);
• infecciones del tracto respiratorio superior (infecciones de nariz y garganta);
• disminución del apetito;
• epistaxis (sangrados nasales intensos);
• infecciones por hongos;
• infecciones por herpes;
• dispepsia (indigestión);
• bacteriemia (presencia de bacterias en la sangre).
Efectos adversos frecuentes
(pueden afectar hasta 1 de cada 10 personas)
• pancitopenia (niveles bajos de todos los tipos de células de la sangre).
Efectos adversos poco frecuentes
(pueden afectar hasta 1 de cada 100 personas)
• parada cardiaca (corazón deja de latir);
• fibrilación ventricular (contracciones peligrosas, irregulares y descoordinadas de las cámaras inferiores del corazón).
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
 5. Conservación de VANFLYTA
5. Conservación de VANFLYTA
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja y el blíster después de EXP. La fecha de caducidad es el último día del mes que se indica.
Este medicamento no requiere condiciones especiales de conservación.
No utilice este medicamento si observa que el envase está dañado o si hay algún signo de manipulación del cierre.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
 6. Contenido del envase e información adicional
6. Contenido del envase e información adicional
Composición de VANFLYTA
• El principio activo es quizartinib.
VANFLYTA 17,7 mg: Cada comprimido recubierto con película contiene 17,7 mg de quizartinib (como dihidrocloruro).
VANFLYTA 26,5 mg: Cada comprimido recubierto con película contiene 26,5 mg de
quizartinib (como dihidrocloruro).
• Los demás componentes son: VANFLYTA 17,7 mg:
Núcleo del comprimido: hidroxipropilbetadex, celulosa microcristalina, estearato de magnesio. Recubrimiento: hipromelosa, talco, triacetina, dióxido de titanio.
VANFLYTA 26,5 mg:
Núcleo del comprimido: hidroxipropilbetadex, celulosa microcristalina, estearato de magnesio. Recubrimiento: hipromelosa, talco, triacetina, dióxido de titanio.
Aspecto del producto y contenido del envase
VANFLYTA 17,7 mg comprimidos recubiertos con película (comprimidos) son de color blanco, redondos y con la inscripción “DSC 511” en una cara, y están disponibles en cajas que contienen
14 x 1 o 28 x 1 comprimidos recubiertos con película en blísteres unidosis de aluminio/aluminio perforados.
VANFLYTA 26,5 mg comprimidos recubiertos con película (comprimidos) son de color amarillo, redondos y con la inscripción “DSC 512” en una cara, y están disponibles en cajas que contienen
14 x 1, 28 x 1 o 56 x 1 comprimidos recubiertos con película en blísteres unidosis de aluminio/aluminio perforados.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización
Daiichi Sankyo Europe GmbH Zielstattstrasse 48
81379 Munich
Alemania
Responsable de la fabricación Daiichi Sankyo Europe GmbH Luitpoldstrasse 1
85276 Pfaffenhofen
Alemania
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
| België/Belgique/Belgien Daiichi Sankyo Belgium N.V.-S.A Tél/Tel: +32-(0) 2 227 18 80 | Lietuva Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 |
| България Daiichi Sankyo Europe GmbH Teл.: +49-(0) 89 7808 0 | Luxembourg/Luxemburg Daiichi Sankyo Belgium N.V.-S.A Tél/Tel: +32-(0) 2 227 18 80 |
| Česká republika Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 | Magyarország Daiichi Sankyo Europe GmbH Tel.: +49-(0) 89 7808 0 |
| Danmark Daiichi Sankyo Nordics ApS Tlf.: +45 (0) 33 68 19 99 | Malta Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 |
| Deutschland Daiichi Sankyo Deutschland GmbH Tel: +49-(0) 89 7808 0 | Nederland Daiichi Sankyo Nederland B.V. Tel: +31-(0) 20 4 07 20 72 |
| Eesti Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 | Norge Daiichi Sankyo Nordics ApS Tlf: +47 (0) 21 09 38 29 |
| Ελλάδα Daiichi Sankyo Europe GmbH Τηλ: +49-(0) 89 7808 0 | Österreich Daiichi Sankyo Austria GmbH Tel: +43-(0) 1 4858642 0 |
| España Daiichi Sankyo España, S.A. Tel: +34 91 539 99 11 | Polska Daiichi Sankyo Europe GmbH Tel.: +49-(0) 89 7808 0 |
| France Daiichi Sankyo France S.A.S Tél: +33 (0) 1 55 62 14 60 | Portugal Daiichi Sankyo Portugal, Unip. LDA Tel: +351 21 4232010 |
| Hrvatska Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 | România Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 |
| Ireland Daiichi Sankyo Ireland Ltd Tel: +353-(0) 1 489 3000 | Slovenija Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 |
| Ísland Daiichi Sankyo Nordics ApS Sími: +354 5357000 | Slovenská republika Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 |
| Italia Daiichi Sankyo Italia S.p.A. Tel: +39-06 85 2551 | Suomi/Finland Daiichi Sankyo Nordics ApS Puh/Tel: +358 (0) 9 3540 7081 |
| Κύπρος Daiichi Sankyo Europe GmbH Τηλ: +49-(0) 89 7808 0 | Sverige Daiichi Sankyo Nordics ApS Tel: +46 (0) 40 699 2524 |
| Latvija Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 | United Kingdom (Northern Ireland) Daiichi Sankyo Europe GmbH Tel: +49-(0) 89 7808 0 |
Fecha de la última revisión de este prospecto: Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.

