 TIBSOVO 250 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
TIBSOVO 250 MG COMPRIMIDOS RECUBIERTOS CON PELICULA
| ATC: Ivosidenib |
| PA: Ivosidenib |
| EXC: Lactosa monohidrato y otros. |
Envases
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
3. - FORMA FARMACÉUTICA
4. - DATOS CLÍNICOS
5. - PROPIEDADES FARMACOLÓGICAS
6. - DATOS FARMACÉUTICOS
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
10. - FECHA DE LA REVISIÓN DEL TEXTO
 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas.
 1. - NOMBRE DEL MEDICAMENTO
1. - NOMBRE DEL MEDICAMENTO
TIBSOVO 250 mg Comp. recub. con película
 2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
2. - COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido recubierto con película contiene 250 mg de ivosidenib. Excipiente con efecto conocido
Cada comprimido recubierto con película contiene lactosa monohidrato equivalente a 9,5 mg de lactosa (ver sección 4.4).
Para consultar la lista completa de excipientes, ver sección 6.1
 3. - FORMA FARMACÉUTICA
3. - FORMA FARMACÉUTICA
Comprimido recubierto con película (comprimido).
Comprimido recubierto con película de color azul, ovalado, aproximadamente de 18 mm de longitud, y grabado con "IVO" en una cara y "250" en la otra.
 4. - DATOS CLÍNICOS
4. - DATOS CLÍNICOS
 4.1 - Indicaciones Terapéuticas de TIBSOVO 250 mg Comp. recub. con película
4.1 - Indicaciones Terapéuticas de TIBSOVO 250 mg Comp. recub. con película
Tibsovo, en combinación con azacitidina, está indicado para el tratamiento de pacientes adultos con leucemia mieloide aguda (LMA) de nuevo diagnóstico con mutación de la isocitrato deshidrogenasa-1 (IDH1) R132, que no son candidatos a quimioterapia de inducción estándar (ver sección 5.1).
Tibsovo en monoterapia está indicado para el tratamiento de pacientes adultos con colangiocarcinoma localmente avanzado o metastásico con mutación IDH1 R132 que hayan recibido al menos una línea previa de tratamiento sistémico (ver sección 5.1).
 4.2 - Posología y administración de TIBSOVO 250 mg Comp. recub. con película
4.2 - Posología y administración de TIBSOVO 250 mg Comp. recub. con película
 4.3 - Contraindicaciones de TIBSOVO 250 mg Comp. recub. con película
4.3 - Contraindicaciones de TIBSOVO 250 mg Comp. recub. con película
Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1. Administración concomitante con inductores potentes del CYP3A4 o dabigatrán (ver sección 4.5). Síndrome del QT largo congénito.
Antecedentes familiares de muerte súbita o arritmia ventricular polimórfica.
Intervalo QT/QTc > 500 ms, independientemente del método de corrección (ver secciones 4.2 y 4.4).
 4.4 - Advertencias y Precauciones de TIBSOVO 250 mg Comp. recub. con película
4.4 - Advertencias y Precauciones de TIBSOVO 250 mg Comp. recub. con película
Síndrome de diferenciación en pacientes con leucemia mieloide aguda
Se ha notificado síndrome de diferenciación tras el tratamiento con ivosidenib (ver sección 4.8). El síndrome de diferenciación puede poner en riesgo la vida o ser mortal si no se trata (ver abajo y sección 4.2). El síndrome de diferenciación se asocia a una proliferación y diferenciación rápida de las células mieloides. Los síntomas incluyen: leucocitosis no infecciosa, edema periférico, pirexia, disnea, derrame pleural, hipotensión, hipoxia, edema pulmonar, neumonitis, derrame pericárdico, erupción cutánea, sobrecarga de líquidos, síndrome de lisis tumoral y aumento de la creatinina.
Los pacientes deben ser informados de los signos y síntomas del síndrome de diferenciación, aconsejar que contacten con su médico inmediatamente si éstos se producen, y sobre la necesidad de llevar la Tarjeta de información para el paciente consigo en todo momento.
Si se sospecha un síndrome de diferenciación, administrar corticoides sistémicos e iniciar la monitorización hemodinámica hasta la resolución de los síntomas y durante un mínimo de 3 días.
Si se observa leucocitosis, iniciar el tratamiento con hidroxicarbamida de acuerdo con los protocolos de atención institucional y leucoaféresis según se indique clínicamente (ver sección 4.5).
Reducir la dosis de corticosteroides e hidroxicarbamida sólo después de la resolución de los síntomas. Los síntomas del síndrome de diferenciación pueden reaparecer con la interrupción prematura del tratamiento con corticosteroides y/o hidroxicarbamida. Interrumpir el tratamiento con Tibsovo si los signos/síntomas graves persisten durante más de 48 horas después del inicio de los corticosteroides sistémicos, y reanudar el tratamiento con 500 mg de ivosidenib una vez al día cuando los signos/síntomas sean moderados o menores y tras la mejoría del estado clínico del paciente.
Prolongación del intervalo QTc
Se ha notificado una prolongación del intervalo QTc tras el tratamiento con ivosidenib (ver sección 4.8).
Se debe realizar un ECG antes de iniciar el tratamiento, al menos semanalmente durante las primeras
3 semanas de tratamiento y posteriormente una vez al mes si el intervalo QTc permanece ≤ 480 ms (ver sección 4.2). Cualquier anomalía debe ser tratada inmediatamente (ver sección 4.2). En caso de sintomatología sugestiva, se debe realizar un ECG según clínicamente indicado. En caso de vómitos y/o diarrea graves, se debe realizar una evaluación de alteraciones en los electrolitos séricos, especialmente de la hipopotasemia y del magnesio.
Se debe informar a los pacientes del riesgo de prolongación del intervalo QT, de sus signos y síntomas (palpitaciones, mareo, síncope o incluso parada cardíaca) y se les debe aconsejar que se pongan en contacto con su médico inmediatamente si se producen.
La administración concomitante con medicamentos que prolongan el intervalo QTc, o con inhibidores moderados o potentes del CYP3A4 puede aumentar el riesgo de prolongación del intervalo QTc y se debe evitar siempre que sea posible durante el tratamiento con Tibsovo. Si no es posible el uso de una alternativa adecuada, los pacientes deben ser tratados con precaución y monitorizados estrechamente por la prolongación del intervalo QTc. Se debe realizar un ECG antes de la coadministración, realizar un seguimiento semanal durante al menos 3 semanas y luego según esté clínicamente indicado. La dosis recomendada de ivosidenib se debe reducir a 250 mg una vez al día si no se puede evitar el uso de inhibidores moderados o potentes del CYP3A4 (ver secciones 4.2 y 4.5).
Si la administración de furosemida (un sustrato de OAT3) está clínicamente indicada para controlar los signos/síntomas del síndrome de diferenciación, los pacientes deben ser monitorizados estrechamente para detectar desequilibrios electrolíticos y prolongación del intervalo QTc.
Los pacientes con insuficiencia cardíaca congestiva o anomalías electrolíticas deben ser vigilados estrechamente, con controles periódicos de ECG y electrolitos, durante el tratamiento con ivosidenib. El tratamiento con Tibsovo se debe interrumpir permanentemente si los pacientes desarrollan una prolongación del intervalo QTc con signos o síntomas de arritmia potencialmente mortal
(ver sección 4.2).
Ivosidenib se debe utilizar con precaución en pacientes con niveles de albúmina por debajo del rango normal, o bien con peso más bajo del normal.
Insuficiencia renal grave
No se ha establecido la seguridad y eficacia de ivosidenib en pacientes con insuficiencia renal grave (TFGe ? 30 ml/min/1,73 m2). Tibsovo se debe utilizar con precaución en pacientes con insuficiencia renal grave y esta población de pacientes debe ser monitorizada estrechamente
(ver secciones 4.2 y 5.2).
Insuficiencia hepática
No se ha establecido la seguridad y eficacia de ivosidenib en pacientes con insuficiencia hepática moderada y grave (clases B y C de Child-Pugh). Tibsovo se debe utilizar con precaución en pacientes con insuficiencia hepática moderada y grave, y esta población de pacientes debe ser monitorizada estrechamente (ver secciones 4.2 y 5.2).
Tibsovo se debe utilizar con precaución en pacientes con insuficiencia hepática leve (clase A de Child- Pugh) (ver sección 4.8).
Sustratos del CYP3A4
Ivosidenib induce el CYP3A4 y podría, por lo tanto, disminuir la exposición sistémica a los sustratos del CYP3A4.
Los pacientes deben ser monitorizados para detectar la pérdida de eficacia antifúngica si no se puede evitar el uso de itraconazol o ketoconazol (ver sección 4.5).
Mujeres en edad fértil / anticoncepción
Las mujeres en edad fértil deben someterse a una prueba de embarazo antes de iniciar el tratamiento con Tibsovo y evitar quedarse embarazadas durante el tratamiento (ver sección 4.6).
Las mujeres en edad fértil y los hombres con parejas femeninas en edad fértil deben utilizar métodos anticonceptivos eficaces durante el tratamiento con Tibsovo y durante, al menos, 1 mes después de la última dosis.
Ivosidenib puede disminuir las concentraciones sistémicas de los anticonceptivos hormonales y, por tanto, se recomienda el uso concomitante de un método anticonceptivo de barrera
(ver secciones 4.5 y 4.6).
Intolerancia a la lactosa
Tibsovo contiene lactosa. Los pacientes con intolerancia hereditaria a galactosa, deficiencia total de lactasa o problemas de absorción de glucosa o galactosa no deben tomar este medicamento.
Contenido en sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por comprimido; esto es, esencialmente "exento de sodio”.
 4.5 - Interacciones con otros medicamentos de TIBSOVO 250 mg Comp. recub. con película
4.5 - Interacciones con otros medicamentos de TIBSOVO 250 mg Comp. recub. con película
Efecto de otros medicamentos sobre ivosidenib
Inductores potentes del CYP3A4
Ivosidenib es sustrato del CYP3A4. Es previsible que la administración concomitante con inductores potentes del CYP3A4 (por ejemplo, carbamazepina, fenobarbital, fenitoína, rifampicina, hierba de San Juan (Hypericum perforatum)) disminuya las concentraciones plasmáticas de ivosidenib, y está
contraindicada durante el tratamiento con Tibsovo (ver sección 4.3). No se han realizado estudios clínicos que evalúen la farmacocinética de ivosidenib en presencia de un inductor del CYP3A4.
Inhibidores moderados o potentes del CYP3A4
En individuos sanos, la administración de una dosis única de 250 mg de ivosidenib y 200 mg de itraconazol una vez al día durante 18 días aumentó el AUC de ivosidenib en un 169% (IC del
90%: 145, 195) sin cambios en la Cmax. La administración concomitante de inhibidores moderados o potentes del CYP3A4 aumenta las concentraciones plasmáticas de ivosidenib. Esto puede aumentar el riesgo de prolongación del intervalo QTc y siempre que sea posible se deben considerar alternativas adecuadas que no sean inhibidores moderados o potentes del CYP3A4 durante el tratamiento con Tibsovo. Si no es posible el uso de una alternativa adecuada los pacientes deben ser tratados con
precaución y ser estrechamente monitorizados por la prolongación del intervalo QTc. Si no se puede
evitar el uso de inhibidores moderados o potentes del CYP3A4, la dosis recomendada de ivosidenib debe reducirse a 250 mg una vez al día (ver secciones 4.2 y 4.4).
? Los inhibidores moderados del CYP3A4 son: aprepitant, ciclosporina, diltiazem, eritromicina, fluconazol, pomelo y zumo de pomelo, isavuconazol, verapamilo.
? Los inhibidores potentes del CYP3A4 son: claritromicina, itraconazol, ketoconazol, posaconazol, ritonavir, voriconazol.
Medicamentos conocidos por prolongar el intervalo QTc
La administración concomitante con medicamentos que prolongan el intervalo QTc
(por ejemplo, antiarrítmicos, fluoroquinolonas, antagonistas de los receptores 5-HT3, antifúngicos triazoles) puede aumentar el riesgo de prolongación del intervalo QTc y se debe evitar siempre que sea posible durante el tratamiento con Tibsovo. Los pacientes deben ser tratados con precaución y ser estrechamente monitorizados por la prolongación del intervalo QTc si no es posible el uso de una alternativa adecuada (ver secciones 4.2 y 4.4).
Efecto de ivosidenib sobre otros medicamentos
Interacciones con transportadores
Ivosidenib inhibe la P-gp y tiene el potencial de inducirla. Por lo tanto, puede alterar la exposición sistémica de sustancias activas que son transportadas predominantemente por la P-gp
(por ejemplo, dabigatrán). La administración concomitante con dabigatrán está contraindicada (ver sección 4.3).
Ivosidenib inhibe la OAT3, el polipéptido transportador de aniones orgánicos 1B1 (OATP1B1) y el polipéptido transportador de aniones orgánicos 1B3 (OATP1B3). Por lo tanto, puede aumentar la exposición sistémica a los sustratos de OAT3 u OATP1B1/1B3. La administración concomitante de sustratos de OAT3 (por ejemplo, bencilpenicilina, furosemida) o sustratos sensibles a OATP1B1/1B3 (por ejemplo, atorvastatina, pravastatina, rosuvastatina) debe evitarse siempre que sea posible durante el tratamiento con Tibsovo (ver sección 5.2). Los pacientes se deben tratar con precaución si no es posible utilizar una alternativa adecuada. Si la administración de furosemida está clínicamente indicada para controlar los signos/síntomas del síndrome de diferenciación, los pacientes deben ser estrechamente monitorizados para detectar desequilibrios electrolíticos y prolongación del intervalo QTc.
Inducción enzimática
Enzimas del citocromo P450 (CYP)
Ivosidenib induce CYP3A4, CYP2B6, CYP2C8, CYP2C9 y puede inducir CYP2C19. Por lo tanto, puede disminuir la exposición sistémica a los sustratos de estas enzimas. Durante el tratamiento con Tibsovo se deben considerar alternativas adecuadas que no sean sustratos de CYP3A4, CYP2B6, CYP2C8 o CYP2C9 con estrecho margen terapéutico, o sustratos de CYP2C19. Los pacientes deben
ser vigilados por la pérdida de eficacia del sustrato si no se puede evitar el uso de dichos medicamentos (ver sección 5.2).
? Los sustratos del CYP3A4 con estrecho margen terapéutico incluyen: alfentanilo, ciclosporina, everólimus, fentanilo, pimozida, quinidina, sirólimus, tacrólimus.
? Los sustratos del CYP2B6 con estrecho margen terapéutico incluyen: ciclofosfamida, ifosfamida, metadona.
? Los sustratos del CYP2C8 con estrecho margen terapéutico incluyen: paclitaxel, pioglitazona, repaglinida.
? Los sustratos del CYP2C9 con estrecho margen terapéutico incluyen: fenitoína, warfarina.
? Los sustratos del CYP2C19 incluyen: omeprazol.
El itraconazol o el ketoconazol no deben utilizarse de forma concomitante con Tibsovo debido a la esperada pérdida de eficacia antifúngica.
Ivosidenib puede disminuir las concentraciones sistémicas de los anticonceptivos hormonales y, por tanto, se recomienda el uso concomitante de un método anticonceptivo de barrera durante al menos
1 mes después de la última dosis (ver secciones 4.4 y 4.6).
Uridina difosfato glucuronosiltransferasas (UGTs)
Ivosidenib tiene el potencial de inducir las UGTs y puede, por lo tanto, disminuir la exposición sistémica de los sustratos de estas enzimas (por ejemplo, lamotrigina, raltegravir). Durante el tratamiento con Tibsovo se deben considerar alternativas adecuadas que no sean sustratos de UGT. Los pacientes deben ser vigilados por la pérdida de eficacia del sustrato UGT si no se puede evitar el uso de dichos medicamentos (ver sección 5.2).
 4.6 - Embarazo y Lactancia de TIBSOVO 250 mg Comp. recub. con película
4.6 - Embarazo y Lactancia de TIBSOVO 250 mg Comp. recub. con película
Mujeres en edad fértil/Anticoncepción
Las mujeres en edad fértil se deben someter a una prueba de embarazo antes de iniciar el tratamiento con Tibsovo y deben evitar quedarse embarazadas durante el tratamiento (ver sección 4.4).
Las mujeres en edad fértil y los hombres con parejas femeninas en edad fértil deben utilizar métodos anticonceptivos eficaces durante el tratamiento con Tibsovo y durante, al menos, 1 mes después de la última dosis.
Ivosidenib puede disminuir las concentraciones sistémicas de los anticonceptivos hormonales y, por lo tanto, se recomienda el uso concomitante de un método anticonceptivo alternativo como los anticonceptivos de barrera (ver secciones 4.4 y 4.5).
Embarazo
No se dispone de datos adecuados sobre el uso de ivosidenib en mujeres embarazadas. Los estudios en animales han mostrado toxicidad para la reproducción (ver sección 5.3).
No se recomienda el uso de Tibsovo durante el embarazo ni en mujeres en edad fértil que no utilicen métodos anticonceptivos eficaces. Los pacientes deben ser informados del riesgo potencial para el feto si se utiliza durante el embarazo o si una paciente (o la pareja femenina de un paciente masculino tratado) se queda embarazada durante el tratamiento o durante el período de un mes después de la última dosis.
Lactancia
Se desconoce si ivosidenib y sus metabolitos se excretan en la leche materna. No se han realizado estudios en animales para evaluar la excreción de ivosidenib y sus metabolitos en la leche. No se puede excluir el riesgo en lactantes.
Se debe interrumpir la lactancia durante el tratamiento con Tibsovo y durante, al menos, 1 mes después de la última dosis.
Fertilidad
No se dispone de datos en humanos sobre el efecto de ivosidenib en la fertilidad. No se han realizado estudios de fertilidad en animales para evaluar el efecto de ivosidenib. Se observaron efectos indeseables en los órganos reproductores en un estudio de toxicidad a dosis repetidas de 28 días
(ver sección 5.3). Se desconoce la relevancia clínica de estos efectos.
 4.7 - Efectos sobre la capacidad de conducción de TIBSOVO 250 mg Comp. recub. con película
4.7 - Efectos sobre la capacidad de conducción de TIBSOVO 250 mg Comp. recub. con película
La influencia de ivosidenib sobre la capacidad para conducir y utilizar máquinas es pequeña. En algunos pacientes que recibían ivosidenib se han notificado fatiga y mareo (ver sección 4.8), lo cual debe tenerse en cuenta al evaluar la capacidad del paciente para conducir o utilizar máquinas.
 4.8 - Reacciones Adversas de TIBSOVO 250 mg Comp. recub. con película
4.8 - Reacciones Adversas de TIBSOVO 250 mg Comp. recub. con película
Leucemia mieloide aguda de nuevo diagnóstico en combinación con azacitidina
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes fueron vómitos (40%), neutropenia (31%), trombocitopenia
(28%), prolongación del intervalo QT del electrocardiograma (21%), insomnio (19%).
Las reacciones adversas graves más frecuentes fueron el síndrome de diferenciación (8%) y trombocitopenia (3%).
En los pacientes tratados con ivosidenib en combinación con azacitidina, la frecuencia de suspensión del tratamiento con ivosidenib debido a reacciones adversas fue del 6%. Las reacciones adversas que condujeron a la suspensión fueron prolongación del intervalo QT del electrocardiograma (1%), insomnio (1%), neutropenia (1%) y trombocitopenia (1%).
La frecuencia de interrupción de la dosis de ivosidenib debido a reacciones adversas fue del 35%. Las reacciones adversas más frecuentes que dieron lugar a la interrupción de la dosis fueron neutropenia (24%), prolongación del intervalo QT del electrocardiograma (7%), trombocitopenia (7%), leucopenia (4%) y síndrome de diferenciación (3%).
La frecuencia de reducción de la dosis de ivosidenib debido a reacciones adversas fue del 19%. Las reacciones adversas que condujeron a la reducción de la dosis fueron prolongación del intervalo QT del electrocardiograma (10%), neutropenia (8%) y trombocitopenia (1%).
Tabla de reacciones adversas
Las frecuencias de las reacciones adversas se basan en el estudio AG120-C-009 que incluyó a
72 pacientes con LMA de nuevo diagnóstico aleatorizados y tratados con ivosidenib (500 mg diarios)
en combinación con azacitidina. La mediana de la duración del tratamiento con Tibsovo fue de
8 meses (rango de 0,1 a 40,0 meses). Las frecuencias de las reacciones adversas se basan en las frecuencias de los acontecimientos adversos por todas las causas, de los cuales, una proporción de los
acontecimientos para una reacción adversa se puede deber a otras causas distintas a ivosidenib, como la propia enfermedad, otros medicamentos o causas no relacionadas.
Las frecuencias se definen como: muy frecuentes (≥ 1/10); frecuentes (≥ 1/100 a < 1/10); poco frecuentes (≥ 1/1 000 a < 1/100); raras (≥ 1/10 000 a < 1/1 000); muy raras (< 1/10 000). Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden de gravedad decreciente.
Tabla 2 - Reacciones adversas al medicamento notificadas en pacientes con LMA de nuevo diagnóstico tratados con ivosidenib en combinación con azacitidina en el estudio clínico AG120-C-009 (N=72)
| Clasificación por órganos y sistemas | Frecuencia | Reacciones adversas |
| Trastornos de la sangre y del sistema linfático | Muy frecuentes | Síndrome de diferenciación, leucocitosis, trombocitopenia, neutropenia |
| Trastornos de la sangre y del sistema linfático | Frecuentes | Leucopenia |
| Trastornos psiquiátricos | Muy frecuentes | Insomnio |
| Trastornos del sistema nervioso | Muy frecuentes | Cefalea, mareo |
| Trastornos del sistema nervioso | Frecuentes | Neuropatía periférica |
| Trastornos gastrointestinales | Muy frecuentes | Vómitos1 |
| Trastornos gastrointestinales | Frecuentes | Dolor orofaríngeo |
| Trastornos musculoesqueléticos y del tejido conjuntivo | Muy frecuentes | Dolor en una extremidad, artralgia, dolor de espalda |
| Exploraciones complementarias | Muy frecuentes | Intervalo QT del electrocardiograma prolongado |
1 El término agrupado incluye vómitos y arcadas.
Colangiocarcinoma localmente avanzado o metastásico, previamente tratado
Resumen del perfil de seguridad
Las reacciones adversas más frecuentes fueron fatiga (43%), náuseas (42%), dolor abdominal (35%), diarrea (35%), disminución del apetito (24%), ascitis (23%), vómitos (23%), anemia (19%) y erupción cutánea (15%).
Las reacciones adversas graves más frecuentes fueron ascitis (2%), hiperbilirrubinemia (2%) e ictericia colestática (2%).
En los pacientes tratados con ivosidenib, la frecuencia de suspensión del tratamiento debido a reacciones adversas fue del 2%. Las reacciones adversas que condujeron a la suspensión fueron ascitis (1%) e hiperbilirrubinemia (1%).
La frecuencia de interrupción de la dosis de ivosidenib debido a reacciones adversas fue del 16%. Las reacciones adversas más frecuentes que dieron lugar a la interrupción de la dosis fueron hiperbilirrubinemia (3%), aumento de la alanina aminotransferasa (3%), aumento de la aspartato aminotransferasa (3%), ascitis (2%) y fatiga (2%).
La frecuencia de reducción de la dosis de ivosidenib debido a reacciones adversas fue del 4%. Las reacciones adversas que condujeron a la reducción de la dosis fueron la prolongación del intervalo QT del electrocardiograma (3%) y la neuropatía periférica (1%).
Tabla de reacciones adversas
Las frecuencias de las reacciones adversas se basan en el estudio AG120-C-005 que incluyó a 123 pacientes con colangiocarcinoma localmente avanzado o metastásico, previamente tratado, aleatorizados y tratados con 500 mg de ivosidenib una vez al día. La mediana de la duración del
tratamiento con Tibsovo fue de 2,8 meses (rango de 0,1 a 45,1 meses; media (desviación estándar
[DE]) de 6,7 (8,2) meses).
Las frecuencias de las reacciones adversas se basan en las frecuencias de los acontecimientos adversos por todas las causas, donde una proporción de los acontecimientos de una reacción adversa puede
tener otras causas distintas a ivosidenib, como la enfermedad, otros medicamentos o causas no relacionadas.
Las frecuencias se definen como: muy frecuentes (≥ 1/10); frecuentes (≥ 1/100 a < 1/10); poco frecuentes (≥ 1/1 000 a < 1/100); raras (≥ 1/10 000 a < 1/1 000); muy raras (< 1/10 000). Dentro de cada grupo de frecuencia, las reacciones adversas se presentan en orden de gravedad decreciente.
Tabla 3 - Reacciones adversas al fármaco notificadas en pacientes con colangiocarcinoma localmente avanzado o metastásico tratados con ivosidenib en el estudio clínico AG120-C-005 (N=123)
| Clasificación por órganos y sistemas | Frecuencia | Reacciones adversas |
| Trastornos de la sangre y del sistema linfático | Muy frecuentes | Anemia |
| Trastornos del metabolismo y la nutrición | Muy frecuentes | Apetito disminuido |
| Trastornos del sistema nervioso | Muy frecuentes | Neuropatía periférica, cefalea |
| Trastornos gastrointestinales | Muy frecuentes | Ascitis, diarrea, vómitos, náuseas, dolor abdominal |
| Trastornos hepatobiliares | Frecuentes | Ictericia colestática, hiperbilirrubinemia |
| Trastornos de la piel y del tejido subcutáneo | Muy frecuentes | Erupción1 |
| Trastornos generales y alteraciones en el lugar de administración | Muy frecuentes | Fatiga |
| Trastornos generales y alteraciones en el lugar de administración | Frecuentes | Caída |
| Exploraciones complementarias | Muy frecuentes | Aspartato aminotransferasa elevada, bilirrubina en sangre elevada |
| Exploraciones complementarias | Frecuentes | Intervalo QT del electrocardiograma prolongado, alanina aminotransferasa aumentada, recuento de leucocitos disminuido, recuento de plaquetas disminuido |
1 El término agrupado incluye erupción, erupción maculopapular, eritema, erupción macular, dermatitis exfoliativa generalizada, erupción medicamentosa e hipersensibilidad a fármaco.
Descripción de las reacciones adversas seleccionadas
Síndrome de diferenciación en pacientes con leucemia mieloide aguda (ver secciones 4.2 y 4.4)
En el estudio AG120-C-009, en los 72 pacientes con LMA de nuevo diagnóstico tratados con Tibsovo en combinación con azacitidina, el 14% experimentó síndrome de diferenciación. Ningún paciente suspendió el tratamiento con ivosidenib debido al síndrome de diferenciación y en una minoría de pacientes fueron necesarias las interrupciones de dosis (3%) para controlar los signos/síntomas. De los
10 pacientes que experimentaron el síndrome de diferenciación, todos se recuperaron después del tratamiento o tras la interrupción de la dosis de Tibsovo. La mediana del tiempo transcurrido hasta la aparición del síndrome de diferenciación fue de 20 días. El síndrome de diferenciación apareció a partir de los 3 días y hasta 46 días después del inicio del tratamiento durante la terapia en combinación.
Prolongación del intervalo QTc (ver secciones 4.2, 4.4 y 4.5)
En el estudio AG120-C-009, de los 72 pacientes con LMA de nuevo diagnóstico tratados con ivosidenib en combinación con azacitidina, el 21% notificó una prolongación del intervalo QT en el electrocardiograma; el 11% experimentó reacciones de grado 3 o superior. Según el análisis de los ECG, en el 15% de los pacientes tratados con ivosidenib en combinación con azacitidina, a los que se les realizó al menos una evaluación del ECG posterior al inicio, se observó un intervalo QTc
? 500 ms, y en el 24% se produjo un aumento del QTc ? 60 ms con respecto al valor inicial. El 1% de los pacientes suspendió el tratamiento con ivosidenib debido a la prolongación del intervalo QT en el electrocardiograma, se requirió la interrupción y la reducción de la dosis en el 7% y 10% de los pacientes, respectivamente. La mediana del tiempo hasta la aparición de la prolongación del intervalo QT en los pacientes tratados con ivosidenib fue de 29 días. La prolongación del intervalo QT en el electrocardiograma se produjo a partir de 1 día y hasta 18 meses después del inicio del tratamiento.
En el estudio AG120-C-005, de los 123 pacientes con colangiocarcinoma localmente avanzado o metastásico tratados con ivosidenib en monoterapia, el 10% notificó una prolongación del intervalo
QT en el electrocardiograma; el 2% experimentó reacciones de grado 3 o superior. Según el análisis de los ECG, el 2% de los pacientes tuvo un intervalo QTc ? 500 ms y el 5% una prolongación del intervalo QTc ? 60 ms con respecto al valor inicial. En el 3% de los pacientes fue necesario reducir la
dosis para controlar los signos/síntomas. La mediana del tiempo hasta la aparición de la prolongación
del intervalo QT en los pacientes tratados con ivosidenib en monoterapia fue de 28 días. La prolongación del intervalo QT del electrocardiograma se produjo a partir de 1 día y hasta 23 meses después del inicio del tratamiento.
Poblaciones especiales
Insuficiencia hepática
No se ha establecido la seguridad y eficacia de ivosidenib en pacientes con insuficiencia hepática moderada y grave (clases B y C de Child-Pugh). Se ha observado una tendencia a una mayor
incidencia de reacciones adversas en pacientes con insuficiencia hepática leve (clase A de Child-Pugh) (Ver secciones 4.2 y 5.2.).
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas a través del sistema nacional de notificación incluido en el Apéndice V.
 4.9 - Sobredosificación de TIBSOVO 250 mg Comp. recub. con película
4.9 - Sobredosificación de TIBSOVO 250 mg Comp. recub. con película
En caso de sobredosis, es probable que la toxicidad se manifieste como una exacerbación de las reacciones adversas asociadas a ivosidenib (ver sección 4.8). Los pacientes deben ser vigilados estrechamente y recibir el tratamiento sintomático adecuado (ver secciones 4.2 y 4.4). No existe un antídoto específico para la sobredosis de ivosidenib.
 5. - PROPIEDADES FARMACOLÓGICAS
5. - PROPIEDADES FARMACOLÓGICAS
 5.1 - Propiedades farmacodinámicas de TIBSOVO 250 mg Comp. recub. con película
5.1 - Propiedades farmacodinámicas de TIBSOVO 250 mg Comp. recub. con película
Grupo farmacoterapéutico: Agentes antineoplásicos; otros agentes antineoplásicos
Código ATC: L01XX62
Mecanismo de acción
Ivosidenib es un inhibidor de la enzima IDH1 mutada. La IDH1 mutada convierte el alfa-cetoglutarato (α-KG) en 2-hidroxiglutarato (2-HG), que bloquea la diferenciación celular y favorece la carcinogénesis en neoplasias malignas tanto hematológicas como no hematológicas. El mecanismo de acción de ivosidenib, más allá de su capacidad para reducir el 2-HG y restaurar la diferenciación celular, no se conoce por completo en todas las indicaciones.
Efectos farmacodinámicos
La administración de múltiples dosis de 500 mg de ivosidenib al día redujeron las concentraciones plasmáticas de 2-HG en pacientes con neoplasias malignas hematológicas y colangiocarcinoma con mutación IDH1 hasta niveles aproximados a los observados en individuos sanos. En la médula ósea de los pacientes con neoplasias malignas hematológicas y en la biopsia tumoral de los pacientes con colangiocarcinoma, la reducción media (% del coeficiente de variación [%CV]) de las concentraciones de 2-HG fue del 93,1% (11,1%) y del 82,2% (32,4%), respectivamente.
Utilizando un modelo de concentración de ivosidenib-QTc, se predijo una prolongación del intervalo QTc dependiente de la concentración de aproximadamente 17,2 ms (IC del 90%: 14,7, 19,7) en el estado estacionario Cmax, en base a un análisis de 173 pacientes con LMA que recibieron 500 mg de ivosidenib una vez al día. Se observó una prolongación del intervalo QTc dependiente de la concentración de aproximadamente 17,2 ms (IC del 90%: 14,3, 20,2) en el estado estacionario Cmax tras una dosis de 500 mg al día, en base a un análisis de 101 pacientes con colangiocarcinoma que recibieron ivosidenib 500 mg al día (ver secciones 4.2 y 4.4).
Eficacia clínica
Leucemia mieloide aguda de nuevo diagnóstico en combinación con azacitidina
La eficacia y seguridad de Tibsovo se evaluaron en un estudio clínico multicéntrico, aleatorizado, doble ciego y controlado con placebo (AG120-C-009) de 146 pacientes adultos con LMA no tratada previamente con una mutación IDH1, que no eran candidatos para recibir quimioterapia de inducción intensiva en base a, al menos, uno de los siguientes criterios: 75 años o mayores, estado funcional del Grupo Oncológico Cooperativo del Este (ECOG, por sus siglas en inglés) de 2, enfermedad cardíaca o pulmonar grave, insuficiencia hepática con bilirrubina > 1,5 veces el límite superior de la normalidad, aclaramiento de creatinina < 45 ml/min, u otra comorbilidad. En todos los individuos se realizaron análisis de mutaciones genéticas para la confirmación centralizada de la mutación IDH1, a partir de médula ósea y/o sangre periférica utilizando el sistema Abbott RealTime™ IDH1. Los pacientes fueron asignados aleatoriamente a recibir Tibsovo 500 mg o el placebo correspondiente por vía oral
una vez al día, con azacitidina 75 mg/m2/día por vía subcutánea o intravenosa durante 1 semana cada 4
semanas, hasta el final del estudio, la progresión de la enfermedad o una toxicidad inaceptable.
La mediana de la edad de los pacientes tratados con Tibsovo fue de 76 años (rango: 58 a 84); el 58%
eran hombres; el 21% eran de raza asiática, el 17% blanca, y del 61% no se informó; y tenían un
estado funcional ECOG de 0 (19%), 1 (44%) o 2 (36%). El 75% de los pacientes tenían LMA de novo. En general, los pacientes tenían un riesgo citogenético documentado favorable (4%), intermedio (67%) o desfavorable/otro (26%) según la evaluación de los investigadores basada en las guías de práctica clínica en oncología de la Red Nacional Integral del Cáncer (NCCN, por sus siglas en inglés) (2017).
La eficacia se basó en la variable primaria de eficacia de supervivencia libre de eventos (SLE), medida desde la fecha de aleatorización hasta el fracaso del tratamiento, recaída tras remisión o muerte por cualquier causa. El fracaso del tratamiento se definió como la imposibilidad de alcanzar la remisión completa (RC) en la semana 24. La supervivencia global (SG), la tasa de RC, la tasa de RC + RC con recuperación hematológica parcial (RC + RCh) y la tasa de respuesta objetiva (TRO) fueron variables secundarias de eficacia cruciales (Tabla 4 y Figura 1).
Tabla 4 - Resultados de eficacia en pacientes con LMA de nuevo diagnóstico en combinación con azacitidina
| Variable | Ivosidenib (500 mg al día) + azacitidina N=72 | Placebo + azacitidina N=74 |
| Supervivencia libre de eventos, eventos (%) Fracaso del tratamiento Recaída Muerte | 46 (63,9) 42 (58,3) 3 (4,2) 1 (1,4) | 62 (83,8) 59 (79,7) 2 (2,7) 1 (1,4) |
| Hazard ratio1 (IC 95%) | 0,33 (0,16; 0,69) | |
| Eventos de SG (%) | 28 (38,9) | 46 (62,2) |
| Mediana de la SG (IC 95%) meses | 24,0 (11,3; 34,1) | 7,9 (4,1; 11,3) |
| Hazard ratio1 (IC 95%) | 0,44 (0,27; 0,73) | |
| RC, n (%) | 34 (47,2) | 11 (14,9) |
| IC 95%2 | (35,3; 59,3) | (7,7; 25,0) |
| Odds ratio3 (IC 95%) | 4,76 (2,15; 10,50) | |
| Tasa de RC + RCh, n (%) | 38 (52,8) | 13 (17,6) |
| IC 95%2 | (40,7; 64,7) | (9,7; 28,2) |
| Odds ratio3 (IC 95%) | 5,01 (2,32; 10,81) | |
| Tasa de RC + RCi, n (%) | 39 (54,2) | 12 (16,2) |
| IC 95%2 | (42,0; 66,0) | (8,7; 26,6) |
| Odds ratio3 (IC 95%) | 5,90 (2,69; 12,97) |
IC: intervalo de confianza; RC = remisión completa; RCh = remisión completa con recuperación hematológica parcial; RCi = remisión completa con recuperación hematológica incompleta; SG = supervivencia global; RP = respuesta parcial.
1 Hazard ratio se estimó mediante un modelo de riesgos proporcionales de Cox estratificado por los factores de
estratificación aleatorizados (estado de la LMA y región geográfica) con PBO+AZA como denominador.
2 IC del porcentaje se calcula con el método de Clopper y Pearson (Binomio exacto).
3 La estimación de Cochran-Mantel-Haenszel (CMH) para la odds ratio se calcula con PBO+AZA como denominador.
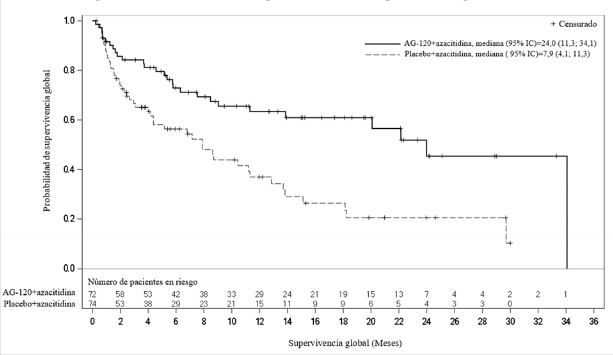
Figura 1: Gráfico de Kaplan Meier de la supervivencia global (SG)
AG120=ivosidenib
Un análisis actualizado de la SG, realizado en el 64,2% (N = 95) de los eventos, confirmó el beneficio en la supervivencia global de Tibsovo en combinación con azacitidina en comparación con placebo en combinación con azacitidina, con una mediana de SG de 29,3 meses frente a 7,9 meses, respectivamente (HR = 0,42; IC del 95%: 0,27 a 0,65).
Colangiocarcinoma localmente avanzado o metastásico previamente tratado
La eficacia de Tibsovo se evaluó en un ensayo clínico de fase 3 aleatorizado (2:1), multicéntrico, doble ciego, controlado con placebo (estudio AG120-C-005), en 185 pacientes adultos con colangiocarcinoma localmente avanzado o metastásico con una mutación IDH1 R132, cuya enfermedad había progresado después de al menos 1 pero no más de 2 regímenes de tratamiento previos que incluían como mínimo un régimen con gemcitabina o 5-FU y una expectativa de supervivencia ≥ 3 meses.
Los pacientes fueron aleatorizados para recibir Tibsovo 500 mg por vía oral una vez al día o el placebo correspondiente hasta la progresión de la enfermedad o el desarrollo de una toxicidad inaceptable. La aleatorización se estratificó en función del número de tratamientos previos (1 o 2). Los pacientes candidatos que fueron asignados aleatoriamente al placebo tuvieron la posibilidad de cambiar al tratamiento con Tibsovo tras la progresión de la enfermedad confirmada mediante revisión radiológica según evaluación del investigador. En todos los individuos se realizaron análisis de mutaciones genéticas para la confirmación centralizada de la mutación IDH1 a partir de una biopsia de tejido tumoral, utilizando la prueba OncomineTM Dx Target.
La mediana de edad fue de 62 años (rango: 33 a 83). La mayoría de los pacientes eran mujeres (63%), el 57% eran de raza blanca y el 37% tenían un estado funcional ECOG de 0 (37%) o 1 (62%). Todos los pacientes recibieron, al menos, una línea de tratamiento sistémica previa y el 47% recibió dos líneas previas. La mayoría de los pacientes tenían colangiocarcinoma intrahepático (91%) en el momento del diagnóstico y el 92% tenía enfermedad metastásica. En ambos brazos, el 70% de los pacientes tenía una mutación R132C, el 15% una mutación R132L, el 12% una mutación R132G, el
1,6% una mutación R132S y el 1,1% una mutación R132H.
La variable primaria de eficacia fue la supervivencia libre de progresión (SLP) determinada por el Centro de Radiología Independiente (IRC, por sus siglas en inglés) según los Criterios de Evaluación de la Respuesta en Tumores Sólidos (RECIST, por sus siglas en inglés) v1.1, que se definió como el tiempo transcurrido desde la aleatorización hasta la progresión de la enfermedad o la muerte por cualquier causa.
La supervivencia global (SG) fue una variable de eficacia secundaria. Según lo permitido por el protocolo, una gran proporción (70,5%) de los pacientes del brazo de placebo pasaron a recibir Tibsovo tras la progresión radiográfica de la enfermedad, según la evaluación del investigador.
Los resultados de eficacia se resumen en la Tabla 5.
Tabla 5 - Resultados de eficacia en pacientes con colangiocarcinoma localmente avanzado o metastásico
| Tasa de SLP (%)3 6 meses 12 meses | 32,0 21,9 | NE NE |
| Ivosidenib (500 mg al día) | Placebo | |
| Supervivencia global4 | N=126 | N=61 |
| Muertes, n (%) | 100 (79) | 50 (82) |
| Mediana de la SG (meses, IC 95%) | 10,3 (7,8; 12,4) | 7,5 (4,8; 11,1) |
| Hazard ratio (IC 95%)1 Valor p2 | 0,79 (0,56; 1,12) 0,093 |
IRC: Centro Radiológico Independiente; IC: Intervalo de Confianza; NE = no estimable.
1 Hazard ratio se calcula a partir del modelo de regresión de Cox estratificado. El factor de estratificación es el número de líneas terapéuticas previas en el momento de la aleatorización.
2 Valor p unilateral se calcula a partir de la prueba de rango logarítmico estratificada sin ajuste por el crossover. El factor de estratificación es el número de líneas terapéuticas previas en el momento de la
aleatorización.
3 Basado en la estimación de Kaplan-Meier. Ningún paciente aleatorizado a placebo logró una SLP de 6 meses o más.
4 Los resultados de la SG se basan en el análisis final de la SG (basado en 150 muertes; corte de datos: 30 de mayo de 2020) que se produjo 16 meses después del análisis final de la SLP (corte de datos: 31 de enero de
2019).
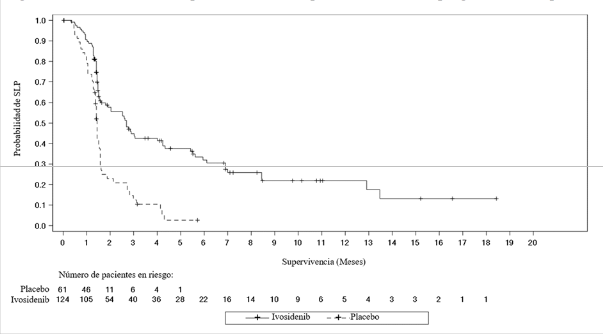
Figura 2: Gráfico de Kaplan Meier de la supervivencia libre de progresión (SLP) por IRC
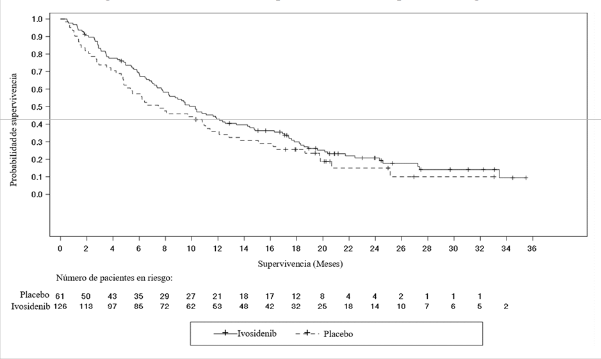
Figura 3: Gráfico de Kaplan-Meier de la supervivencia global
Población pediátrica
La Agencia Europea de Medicamentos ha eximido al titular de la obligación de presentar los resultados de los ensayos realizados con Tibsovo en todos los grupos de la población pediátrica en el tratamiento de todas las afecciones incluidas en la categoría de neoplasias malignas (excepto los tumores del sistema nervioso central y las neoplasias del tejido hematopoyético y linfoide) y en el tratamiento de las neoplasias malignas del sistema nervioso central.
La Agencia Europea de Medicamentos ha concedido al titular un aplazamiento para presentar los resultados de los ensayos realizados con Tibsovo en uno o más grupos de la población pediátrica en el tratamiento de la leucemia mieloide aguda (ver sección 4.2 para consultar la información sobre el uso en la población pediátrica).
 5.2 - Propiedades farmacocinéticas de TIBSOVO 250 mg Comp. recub. con película
5.2 - Propiedades farmacocinéticas de TIBSOVO 250 mg Comp. recub. con película
Un total de 10 estudios clínicos han contribuido a la caracterización de la farmacología clínica de ivosidenib. Cinco estudios se han llevado a cabo en individuos sanos y 3 en pacientes con enfermedades malignas avanzadas, incluidos 2 estudios en pacientes con colangiocarcinoma. Se han realizado 2 estudios en pacientes con LMA de nuevo diagnóstico que recibieron ivosidenib en combinación con azacitidina. Los parámetros farmacocinéticos se han evaluado en plasma y orina. Los parámetros farmacodinámicos se han evaluado en plasma, orina, biopsia tumoral y médula ósea (sólo para los estudios en pacientes con neoplasias malignas avanzadas).
La farmacocinética en el estado estacionario de ivosidenib 500 mg fue comparable entre los pacientes con LMA de nuevo diagnóstico y con colangiocarcinoma.
Absorción
Tras una dosis oral única de 500 mg, la mediana del tiempo hasta la Cmax (Tmax) fue de aproximadamente 2 horas en pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib y azacitidina, y en pacientes con colangiocarcinoma.
En los pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib (dosis de
500 mg al día) y azacitidina, la Cmax media en el estado estacionario fue de 6 145 ng/ml (CV%: 34) y la media del AUC en estado estacionario fue de 106 326 ng?hr/ml (CV%: 41).
En pacientes con colangiocarcinoma, la Cmax media fue de 4 060 ng/ml (%CV: 45) tras una dosis única de 500 mg y de 4.799 ng/ml (CV%: 33) en el estado estacionario para 500 mg diarios. El AUC fue de
86 382 ng?hr/ml (CV%: 34).
Los ratios de acumulación fueron de aproximadamente 1,6 para el AUC y 1,2 para la Cmax en pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib y azacitidina, y de aproximadamente 1,5 para el AUC y 1,2 para la Cmax en pacientes con colangiocarcinoma, durante un mes, cuando se administraron 500 mg al día de ivosidenib. Los niveles plasmáticos en el estado estacionario se alcanzaron en los 14 días siguientes a la administración de una dosis diaria.
Se observaron aumentos significativos de la Cmax de ivosidenib (aproximadamente un 98%; IC del
90%: 79, 119) y del AUCinf (aproximadamente un 25%) tras la administración de una dosis única con una comida rica en grasas (aproximadamente de 900 a 1 000 calorías, 56% a 60% de grasa) en individuos sanos (ver sección 4.2).
Distribución
Según un análisis farmacocinético poblacional, el volumen medio aparente de distribución de ivosidenib en estado estacionario (Vc/F) es de 3,20 l/kg (CV%: 47,8) en pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib y azacitidina y de 2,97 l/kg (CV%: 25,9) en pacientes con colangiocarcinoma tratados con ivosidenib en monoterapia.
Biotransformación
Ivosidenib fue el componente predominante (> 92%) de la radiactividad total en el plasma de individuos sanos. Se metaboliza principalmente por vías oxidativas mediadas en gran medida por el CYP3A4, con contribuciones menores por las vías de N-desalquilación e hidrólisis.
Ivosidenib induce el CYP3A4 (incluyendo su propio metabolismo), el CYP2B6, el CYP2C8, el CYP2C9, y puede inducir el CYP2C19 y las UGTs. Por lo tanto, puede disminuir la exposición sistémica a los sustratos de estas enzimas (ver secciones 4.4, 4.5 y 4.6).
Ivosidenib inhibe la P-gp in vitro y tiene el potencial de inducir la P-gp. Por lo tanto, puede alterar la exposición sistémica a sustancias activas que son transportadas predominantemente por la P-gp (ver secciones 4.3 y 4.5).
Los datos in vitro sugieren que ivosidenib tiene el potencial de inhibir la OAT3, la OATP1B1 y la OATP1B3 a concentraciones clínicamente relevantes y puede, por tanto, aumentar la exposición sistémica a los sustratos de la OAT3, la OATP1B1 o la OATP1B3 (ver sección 4.5).
Eliminación
En pacientes con LMA de nuevo diagnóstico tratados con una combinación de ivosidenib y azacitidina, el aclaramiento aparente medio de ivosidenib en el estado estacionario fue de 4,6 l/hora (35%) con una semivida terminal media de 98 horas (42%).
En pacientes con colangiocarcinoma, el aclaramiento aparente medio de ivosidenib en el estado estacionario fue de 6,1 l/hora (31%) con una semivida terminal media de 129 horas (102%).
En individuos sanos, el 77% de una dosis oral única de ivosidenib se encontró en las heces, recuperándose el 67% inalterado. Aproximadamente el 17% de una dosis oral única se encontró en la orina, recuperándose el 10% inalterado.
Linealidad/No linealidad
El AUC y la Cmax de ivosidenib aumentaron de forma menor que proporcional a la dosis de 200 mg a
1 200 mg una vez al día (0,4 a 2,4 veces la dosis recomendada).
Poblaciones especiales
Edad avanzada
No se observaron efectos clínicamente significativos en la farmacocinética de ivosidenib en pacientes de hasta 84 años. Se desconoce la farmacocinética de ivosidenib en pacientes de 85 años de edad o mayores (ver sección 4.2).
Insuficiencia renal
No se observaron efectos clínicamente significativos en la farmacocinética de ivosidenib en pacientes con insuficiencia renal leve o moderada (TFGe ≥ 30 ml/min/1,73 m2). Se desconoce la farmacocinética de ivosidenib en pacientes con insuficiencia renal grave (TFGe < 30 ml/min/1,73 m2) o con insuficiencia renal que requiere diálisis (ver sección 4.2).
Insuficiencia hepática
Utilizando la clasificación del NCI, no se observaron efectos clínicamente significativos en la farmacocinética de ivosidenib en pacientes con insuficiencia hepática leve. La farmacocinética de ivosidenib en pacientes con insuficiencia hepática moderada y grave se desconoce en pacientes con LMA de nuevo dianóstico o con colangiocarcinoma (ver sección 4.2). No se dispone de datos de PK en pacientes con insuficiencia hepática estratificada según la clasificación de Child-Pugh.
Otros
No se observaron efectos clínicamente significativos en la farmacocinética de ivosidenib en función del sexo, la raza, el peso corporal o el estado funcional ECOG.
 5.3 - Datos preclínicos sobre seguridad de TIBSOVO 250 mg Comp. recub. con película
5.3 - Datos preclínicos sobre seguridad de TIBSOVO 250 mg Comp. recub. con película
Farmacología de seguridad
El potencial de ivosidenib para la prolongación del intervalo QT se puso de manifiesto en estudios preclínicos in vitro e in vivo a niveles plasmáticos clínicamente relevantes.
Toxicidad a dosis repetidas
En estudios en animales con exposiciones clínicamente relevantes, ivosidenib indujo anomalías hematológicas (hipocelularidad de la médula ósea, depleción linfocítica, disminución de la masa de glóbulos rojos junto con hematopoyesis extramedular en el bazo), toxicidad gastrointestinal, hallazgos tiroideos (hipertrofia/hiperplasia de células foliculares en ratas), toxicidad hepática (transaminasas elevadas, aumento de peso, hipertrofia hepatocelular y necrosis en ratas e hipertrofia hepatocelular asociada a un aumento de peso del hígado en monos) y hallazgos renales (vacuolación tubular y necrosis en ratas). Los efectos tóxicos observados en el sistema hematológico, sistema gastrointestinal y riñón fueron reversibles, mientras que los efectos tóxicos en hígado, bazo y tiroides se seguían observando tras el periodo de recuperación.
Genotoxicidad y carcinogenicidad
Ivosidenib no fue mutagénico ni clastogénico en ensayos convencionales de genotoxicidad in vitro e in vivo. No se han realizado estudios de carcinogenicidad con ivosidenib.
Toxicidad para la reproducción y el desarrollo
No se han realizado estudios de fertilidad con ivosidenib. En el estudio de toxicidad a dosis repetidas de 28 días en ratas, se observó atrofia uterina en las hembras a niveles de dosis no tolerados de aproximadamente 1,7 veces la exposición clínica (en base al AUC) y fue reversible después de un período de recuperación de 14 días. En los machos se observó degeneración testicular a niveles de dosis no tolerados de aproximadamente 1,2 veces la exposición clínica (en base al AUC) en animales sometidos a eutanasia prematura.
En estudios de desarrollo embriofetal en ratas, se observó un menor peso corporal del feto y un retraso en la osificación del esqueleto en ausencia de toxicidad materna. En conejos, se observó toxicidad materna, abortos espontáneos, disminución del peso corporal del feto, aumento de la pérdida post implantación, retraso en la osificación del esqueleto y variación del desarrollo visceral (bazo
pequeño). Los estudios en animales indican que ivosidenib atraviesa la placenta y se encuentra en el plasma fetal. En ratas y conejos, los niveles sin efectos adversos observados para el desarrollo embriofetal fueron 0,4 veces y 1,4 veces la exposición clínica (en base al AUC), respectivamente.
 6. - DATOS FARMACÉUTICOS
6. - DATOS FARMACÉUTICOS
 6.1 - Lista de excipientes de TIBSOVO 250 mg Comp. recub. con película
6.1 - Lista de excipientes de TIBSOVO 250 mg Comp. recub. con película
Núcleo del comprimido
Celulosa microcristalina
Croscarmelosa sódica
Succinato acetato de hipromelosa
Sílice coloidal anhidra Estearato de magnesio Laurilsulfato de sodio (E487)
Película de recubrimiento
Hipromelosa
Dióxido de titanio (E171) Lactosa monohidrato Triacetina
Laca de aluminio carmín de índigo (E132)
 6.2 - Incompatibilidades de TIBSOVO 250 mg Comp. recub. con película
6.2 - Incompatibilidades de TIBSOVO 250 mg Comp. recub. con película
No procede.
 6.3 - Período de validez de TIBSOVO 250 mg Comp. recub. con película
6.3 - Período de validez de TIBSOVO 250 mg Comp. recub. con película
5 años.
 6.4 - Precauciones especiales de conservación de TIBSOVO 250 mg Comp. recub. con película
6.4 - Precauciones especiales de conservación de TIBSOVO 250 mg Comp. recub. con película
Este medicamento no requiere ninguna temperatura especial de conservación. Mantener el frasco perfectamente cerrado para protegerlo de la humedad.
 6.5 - Naturaleza y contenido del recipiente de TIBSOVO 250 mg Comp. recub. con película
6.5 - Naturaleza y contenido del recipiente de TIBSOVO 250 mg Comp. recub. con película
Frasco de polietileno de alta densidad (HDPE) con cierre de polipropileno (PP) a prueba de niños y revestimiento de polietileno (PE) termosellado por inducción. Cada frasco contiene 60 comprimidos recubiertos con película y un desecante de gel de sílice en el envase de HDPE.
 6.6 - Precauciones especiales de eliminación y otras manipulaciones de TIBSOVO 250 mg Comp. recub. con película
6.6 - Precauciones especiales de eliminación y otras manipulaciones de TIBSOVO 250 mg Comp. recub. con película
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él se realizará de acuerdo con la normativa local.
 7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
7. - TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Les Laboratoires Servier
50, rue Carnot
92284 Suresnes cedex
Francia
 8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
8. - NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
EU/1/23/1728/001
 9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
9. - FECHA DE LA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 04 mayo 2023
 10. - FECHA DE LA REVISIÓN DEL TEXTO
10. - FECHA DE LA REVISIÓN DEL TEXTO
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos http://www.ema.europa.eu, y en la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) (http://www.aemps.gob.es/)

